Критическое состояние
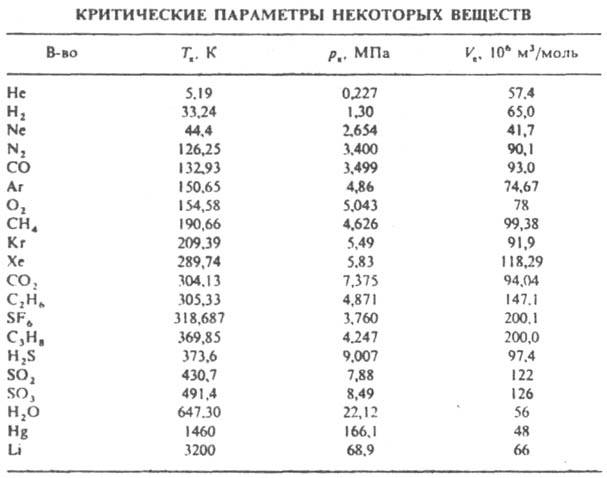
КРИТИЧЕСКОЕ СОСТОЯНИЕ (критич. фаза), состояние двухфазной системы, в к-ром сосуществующие в равновесии фазы (напр., жидкость и ее насыщ. пар или две несмешивающиеся жидкости) становятся тождественными по всем своим св-вам. Параметры критического состояния системы (давление рк, т-ра Тк, объем Vк, состав xк и др.) наз. критич. параметрами. За пределами критического состояния сосуществование рассматриваемых фаз в равновесии невозможно, система превращ. в однофазную (гомогенную). В этом смысле критическое состояние является предельным случаем двухфазного равновесия. В критическом состоянии поверхностное (межфазное) натяжение на границе раздела сосуществующих фаз равно нулю, поэтому вблизи критического состояния легко образуются системы, состоящие из мн. капель или пузырьков (эмульсии, аэрозоли, пены). Вблизи критического состояния резко возрастает величина флуктуации плотности (в случае чистых в-в) и концентраций компонентов (в многокомпонентных системах), что приводит к значит. изменению ряда физ. св-в в-ва (см. Критические явления). При приближении к критическому состоянию св-ва сосуществующих в равновесии фаз (плотность, теплоемкость и др.) изменяются постепенно, без скачка. Поэтому критическое состояние наблюдается лишь при равновесии изотропных фаз [жидких и (или) газовых] или кристаллич. фаз с одинаковым типом решетки. Независимо от природы сосуществующих фаз (типа двухфазного равновесия) и числа компонентов в критическом состоянии система имеет вариантность на 2 меньше, чем в обычном гомогенном состоянии (см. Фаз правило). В чистых в-вах (однокомпонентных системах) критическое состояние всегда имеет место для равновесия жидкость - пар (если в-во при критич. параметрах сохраняет свои хим. св-ва). На диаграмме состояния критическому состоянию отвечает конечная точка кривой равновесия, наз. критич. точкой (критическое состояние нонвариантно). В табл. представлены критич. параметры Тк и рк ряда в-в. Изотермы на диаграммах р - V (рис. 1) при т-рах ниже Tк представляют собой ломаные линии с горизонтальными участками а1-b1, а2-b2, .... Геом. место точек типа а и b образует пограничную кривую аКb, разделяющую области двухфазного состояния (сосуществующих жидкости и пара) и гомогенных состояний - чистой жидкости (ветвь аК) и пара (ветвь Kb). При Tk изотерма является плавной кривой, имеющей точку перегиба с горизонтальной касательной. Выше Tк ни при каких давлениях невозможно существование жидкости в равновесии с паром. Ур-ния критич. точки имеют вид: (дp/дV)Tк=0, (д2р/дV2)Tк=0. Согласно этим ур-ниям, в критическом состоянии давление в системе не изменяется при изотермич. изменении объема. Слабая зависимость давления от объема может сохраняться в значит. интервале т-р и давлений вдали от критич. точки. Иногда критическое состояние наблюдается в равновесии двух кристаллич. модификаций. Напр., Zr имеет две модификации с гранeцeнтрир. кубич. решетками, параметры к-рых сближаются с ростом давления и т-ры и становятся идентичными при 350-400°С и (20-22).108 Па.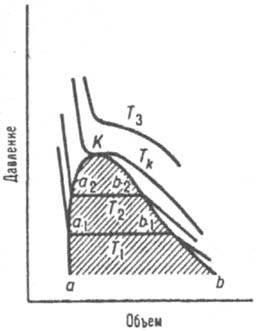
Рис. 1. Диаграмма равновесия жидкость пар для чистого вещества. Т1. Т2, Tк, Т3 - изотермы, К грипп, точка, аКb - пограничная кривая; заштрихована область двухфазного равновесия.
В двойных системах критическое состояние всегда заканчивается равновесное сосуществование жидкой и паровой фаз, как и в чистых в-вах. Для нск-рых систем с ограниченной взаимной р-римостью компонентов существуют, кроме того, критические состояния как предельные случаи равновесного сосуществования двух жидких, двух газовых или двух кристаллич. фаз (твердых р-ров). В нск-рых случаях возможное в принципе критическое состояние может не реализоваться, если на рассматриваемое двухфазное равновесие накладывается равновесие др. фаз (напр., при понижении т-ры или повышении давления начнется кристаллизация одной или обеих жидких фаз). На диаграмме состояния двойной системы критическому состоянию отвечает критич. кривая. Для любого типа двухфазного равновесия критическое состояние может быть изображено точкой на диаграмме в координатах хим. потенциал i-го компонента mi - молярная доля этого компонента xi (рис. 2). Ур-ния критического состояния имеют вид:
(дmi/дхi)Pк.Тк=0, (д2mi/дxi2)Рк.Тк=0.
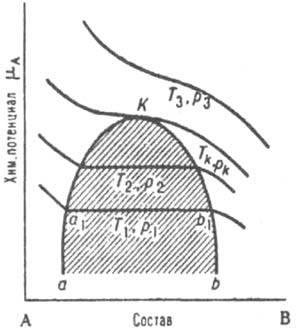
Рис. 2. Зависимость хим. потенциала mА компонента А двойной системы А-В от состава. T1p1, T2p2, Tкpк, T3p3 - изотермы-изобары, К - критич. точка, аКb - пограничная кривая; заштрихована область двухфазного равновесия, в к-рой хим. потенциал не зависит от состава.
Согласно этим ур-ниям, в критическом состоянии компонента mi не изменяется при изобарно-изотсрмич. изменении состава системы. Слабая зависимость mi от состава может сохраняться в значит. температурном диапазоне вдали от Тк. Равновесие жидкость - газ на плоской диаграмме состояния в координатах давление - состав изображается изотермами (рис. 3), к-рые состоят из кривых конденсации (сплошные
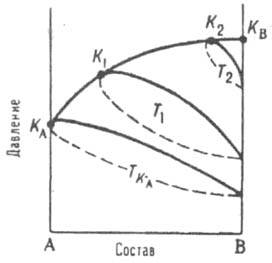
Рис. 3. Диаграмма равновесия жидкость газ для двойной системы А - В. ТKA, Т1, Т2 изотермы, КAК1K2KB, критич. кривая. KА и КB критич, точки чистых А и В соответственно.
линии) и кривых кипения (пунктир). Эти кривые замыкаются в критич. точках К1, К2, ..., геом. место к-рых КАК1К2КВ является проекцией пространств. критич. кривой в данной системе координат. Критич. кривая заканчивается в критич. точках чистых компонентов КА и КB соответственно. По мере повышения т-ры область двухфазного состояния системы уменьшается, стягиваясь при Тк в точку, совпадающую с критич. точкой более летучего компонента, напр. КB.

Рис. 4. Диаграмма равновесия жидкость - жидкость для двойной системы А - В. КB и KA верхняя и нижняя критич. точки смешения (р-римости) соотв., аКBbКA - пограничная кривая; заштрихована область двухфазного равновесия.
Равновесие жидкость - жидкость может заканчиваться верхней критич. точкой смешения (р-римости) или ниж. критич. точкой смешения (р-римости), в зависимости от того, увеличивается или уменьшается взаимная р-римость компонентов с повышением т-ры. В общем случае система может иметь обе критич. точки; пограничная кривая, отделяющая область гомогенного состояния системы при любых составах от области ее расслаивания на две жидкие фазы, имеет вид замкнутого овала (рис. 4). В двойных системах с ограниченной взаимной р-римостью газов наблюдается критическое состояние для равновесия газ-газ. Экспериментально обнаружены только ниж. критич. точки смешения газов, хотя в принципе возможно существование и верх. точек. Критическое состояние газов бывает двух типов. Первый обнаружен в смесях, одним из компонентов к-рых является Не. Расслаивание газовой смеси начинается в критич. точке менее
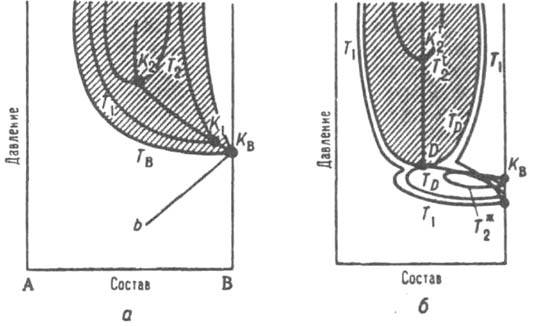
Рис. 5. Диаграмма равновесия газ газ для двойной системы А В. KB, критич точка менее летучего компонента В; заштрихована область двухфазного равновесия газ-газ. а - равновесие газ-газ первого типа; TB Т1. Т2 - изотермы равновесия газ газ. КBK1K2 критич. кривая равновесия газ газ, bКB - участок критич. кривой равновесия жидкость - газ; 6 равновесие второго типа: T1, ТD, Т* - изотермы равновесия жидкость газ. TD, Тn2 - изотермы равновесия газ - газ. DK2 - участок критич. кривая равновесия газ-газ, D - двойная критич. точка.
летучего компонента (КB на рис. 5,а). По мере повышения т-ры (изотермы T1, T2,...) интервал составов, соответствующих двухфазному состоянию газовой смеси, сужается, а давление повышается. Вся критич. кривая расположена при более высоких давлениях и т-рах, чем кривые равновесия жидкость - пар. В случае критического состояния второго типа расслаивание газовой смеси начинается при т-рe, для к-рой еще наблюдается равновесие жидкость - пар, т.е. при т-ре ниже критич. точки менее летучего компонента КB (рис. 5,5). Изотерма равновесия жидкость-газ соприкасается с изотермой равновесия газ-газ в точке D, к-рая является двойной критич. точкой. Для равновесия кристалл-кристалл критическое состояние было обнаружено в случае системы палладий - водород (твердый р-р внедрения). Критич. параметры - 19,9 атм и 295,3 oC; ниже этих значений существуют две кристаллич. фазы с одинаковой решеткой, но разл. содержанием водорода, выше - система является гомогенной. Впоследствии было найдено критическое состояние и для твердых р-ров замещения, напр. в системе NaCl-KCl. Критич. кривые могут иметь особые точки, в к-рых термодинамич. поведение системы отличается от поведения в остальных точках критич. кривой. Особыми точками являются, напр., критич. точки равновесия жидкость-пар в случае бесконечно разбавленных р-ров. Их особенность состоит в том, что в пределах xi:0 значения нек-рых св-в системы зависят от пути подхода к этому пределу. Напр., парциальный молярный объем р-рителя равен молярному объему чистого р-рителя только в том случае, если переход хi:0 происходит при давлениях и т-рах, к-рые являются критич. параметрами для чистого р-рителя, вдали от критич. точки парциальный молярный объем р-рителя в бесконечно разбавленном р-ре при любых т-рах и давлениях равен молярному объему чистого р-рителя. Критич. точка азеотропной смеси, а также точки минимума или максимума на критич. кривой тоже считаются особыми. Для системы, показанной на рис. 5, б. особой точкой считается точка D, т. к. в ней кривые зависимости составов равновесных жидкости и пара от давления изменяют направление на противоположное. В многокомпонентных системах также возможны двухфазные равновесия разл. типов, оканчивающиеся критическим состоянием. В тройных системах критич. точки образуют критич. пов-сть с несколькими особыми точками. наиб. важно появление критич. точек высшего порядка, в к-рых сливаются критич. кривые равновесий жидкость - жидкость (в присут. газовой фазы) и жидкость-пар (в присут. второй жидкой фазы).
Осн. положения классич. (феноменологич.) теории критического состояния были сформулированы Дж. .Гиббсом и обобщены Л. Д. Ландау. Эта теория позволяет предсказать поведение в-ва в критическом состоянии по известным св-вам двухфазного состояния. Расчеты по совр. флуктуац. теории дают более точное соответствие опытным данным. Изучение критического состояния имеет важное практич. значение. Мн. технол. процессы, в частности нефте- и газодобывающие, высокотемпературные энергетические, протекают в условиях, близких к критич. параметрам систем, и в закритич. области параметров. Для разработки и проектирования таких процессов важно знать общую картину фазовых равновесий, включая все их границы (критич. кривые), а также особенности поведения систем вблизи критического состояния и в закритич. области. Литература
