Конкурирующих реакций метод
КОНКУРИРУЮЩИХ РЕАКЦИЙ МЕТОД в химической кинетике, основан на том, что одна и та же активная частица (атом, своб. радикал, ион) может одновременно участвовать в неск. р-циях с образованием разл. продуктов. Условия подбираются такими, при к-рых параллельные р-ции протекают с соизмеримыми скоростями. Из соотношения скоростей этих р-ций (или концентраций образовавшихся продуктов) вычисляют отношения констант скорости р-ций исследуемой частицы с соответствующими реагентами. Конкурирующих реакций метод применяют для изучения гл. обр. радикальных и ионных р-ций; он позволяет вычислять абс. значения констант скорости быстрых р-ций, оценивать реакц. способность разл. атомных групп в молекуле, в сочетании с методом изотопных индикаторов определять кинетический изотопный эффект. Конкурирующие р-ции м. б. разного типа. В частности, это м.б. конкуренция между моно- и бимолекулярной р-циями. Напр., при термич. распаде трет-бутилпероксида в присут. углеводорода RH протекают р-ции: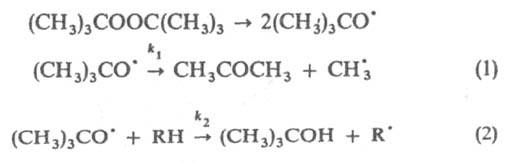
Образующиеся радикалы
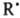 ,
, 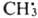 и
и 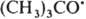 рекомбинируют. Отношение скоростей р-ций (2) и (1) v2/v1=k2[RH]/kl. Если в системе избыток RH, то v2/vl=[(СН3)3СОН]/[СН3СОСН3] и можно определить k2/k1=[(CH3)3COH]/[СН3СОСН3] [RH]. Поскольку известна при т-ре Т k1=3,2.1013ехр[(-69 кДж/моль-1)/RT] с-1 (газовая фаза), метод позволяет определить k2 (R-газовая постоянная). При изучении радикальных р-ций часто используют конкуренцию между рекомбинацией радикалов и их взаимод. с молекулами. Напр., при изучении р-ций СН3 проводят фотолиз паров ацетона в присут. углеводорода RH, что вызывает протекание р-ций:
рекомбинируют. Отношение скоростей р-ций (2) и (1) v2/v1=k2[RH]/kl. Если в системе избыток RH, то v2/vl=[(СН3)3СОН]/[СН3СОСН3] и можно определить k2/k1=[(CH3)3COH]/[СН3СОСН3] [RH]. Поскольку известна при т-ре Т k1=3,2.1013ехр[(-69 кДж/моль-1)/RT] с-1 (газовая фаза), метод позволяет определить k2 (R-газовая постоянная). При изучении радикальных р-ций часто используют конкуренцию между рекомбинацией радикалов и их взаимод. с молекулами. Напр., при изучении р-ций СН3 проводят фотолиз паров ацетона в присут. углеводорода RH, что вызывает протекание р-ций: 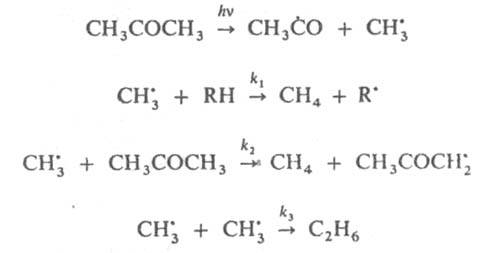
Измеряются скорости образования метана
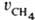 и этана
и этана 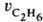 ; отношение
; отношение 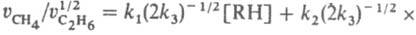
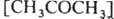 ,
, что позволяет вычислить k1 и k2 при известной k3=2.1010 л/моль.с (газовая фаза, давление выше 10 кПа). Этим методом измерены константы скорости гомолитич. распада для неск. сотен соединений. Если в молекуле имеется неск. реакц. центров, анализ образующихся изомеров позволяет определить относит, реакц. способность каждого из этих центров. Напр., при нитровании толуола азотной к-той образуются о-, м- и n-нитротолуолы:
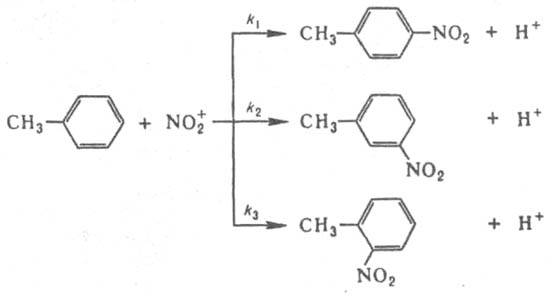
Соотношение между кол-вами о-, м- и n-нитротолуолов равно 2k3:2k2:k1.
Литература
Кондратьев В. Н., Определение констант скорости газофазных реакций, М., 1971; Денисов Е. Т., Кинетика гомогенных химических реакций, М.. 1978. Е. Т. Денисов.
Ещё по теме
Реакционная способность — квантово-химические теории и влияние среды
Химические реакции — механизмы и кинетика
Кинетические методы анализа в химии
Фотохимическое последействие — метод исследования радикальных реакций
Согласованные реакции в химии — основные аспекты
Реппе реакции в органической химии
Химическая кинетика — основные понятия и законы
Катализ в химии и биологии — основные принципы и применение
Цепные реакции в химии — механизм, стадии и кинетика
