Электрохимический эквивалент
ЭЛЕКТРОХИМИЧЕСКИЙ ЭКВИВАЛЕНТ, количество в-ва, претерпевшего хим. превращение на электроде при пропускании единицы кол-ва электричества при условии, что все пропущенное электричество тратится только на превращение данного в-ва. Электрохимический эквивалент имеет размерность мг/Кл. Т.к. согласно первому закону Фарадея при электролизе масса в-ва т, участвующего в электродном процессе, пропорциональна кол-ву пропущенного электричества Q (т = kQ), то электрохимический эквивалент численно равен коэф. пропорциональности k в ур-нии этого закона. Согласно второму закону Фарадея массы в-в, подвергающихся электролизу одним и тем же кол-вом электричества, пропорциональны их электрохимическим эквивалентам. Электрохимический эквивалент хим. элемента м. б. получен из соотношения: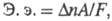 где А - ат. м. элемента;
где А - ат. м. элемента;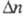 - изменение его степени окисления в электрохим. р-ции; F - Фарадея постоянная. Электрохимический эквивалент соединения рассчитывают по ф-ле:
- изменение его степени окисления в электрохим. р-ции; F - Фарадея постоянная. Электрохимический эквивалент соединения рассчитывают по ф-ле: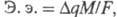 где М - мол. м. соединения;
где М - мол. м. соединения;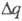 -число электронов, к-рое необходимо для электрохим. превращения одной молекулы этого соединения.
-число электронов, к-рое необходимо для электрохим. превращения одной молекулы этого соединения.
O. А. Петрий.

Дополнения к описанию электрохимического эквивалента: