Трихлорэтаны
ТРИХЛОРЭТАНЫ C2H3Cl3, мол. м. 133,41. Известны 1,1,2-трихлорэтан CHCl2CH2Cl и 1,1,1-трихлорэтан (метилхлороформ) CH3CCl3, бесцв. жидкости (см. табл.) со сладковатым запахом, хорошо раств. во мн. орг. р-рителях. Для 1,1,2-трихлорэтана р-римость в воде (% по массе): 0,45 (20 0C), 0,50 (80 0C), р-римость воды в 1,1,2-трихлорэтане 0,16 (30 0C); с водой образует азеотропную смесь (т. кип. 86 0C, 16,4% воды). Энергии связей (кДж/моль): C-H (для группы CH2Cl) 390,8, C-Cl (для CHCl2 и CH2Cl) 323,4 и 335,1 соотв., С — С 363,2. Для 1,1,1-трихлорэтана р-римость в воде (% по массе): 0,159 (О 0C), 0,132 (20 0C), 0,128 (50 0C); р-римость воды в 1,1,1-трихлорэтане 0,016 (О 0C), 0,042 (30 0C).
Хлорирование трихлорэтанов в жидкой фазе в присут. инициаторов (порофор) при 80-90 0C приводит к тетрахлорэтанам и далее к гексахлорэтану. При дегидрохлорировании в жидкой фазе с помощью Ca(OH)2 при 30-90 0C образуется винилиденхло-рид; при применении NaOH и KOH - хлорацетилен (для 1,1,1-трихлорэтана р-ция протекает бурно, иногда со взрывом). При дегидрохлорировании в газовой фазе (400-450 0C) или на катализаторе (250-300 0C, BaCl2 на активир. угле и др.)
1.1.1-Трихлорэтан дает винилиденхлорид, 1,1,2-трихлорэтан- примерно равную смесь винилиденхлорида и цис- и транс-дихлорэтиленов [в присут. основных катализаторов (высококипящих аминов, KF на пемзе) образуется преим. винилиденхлорид]. Гидролиз 1.1.2-трихлорэтана приводит к хлорацетальдегиду, а 1,1,1-трихлорэтана- к ацетил-хлориду. 1,1,1-Трихлорэтан легко окисляется даже при комнатной т-ре, р-ция ускоряется в присут. следов воды и нек-рых металлов (Al, Fe и др.); при этом образуются фосген, HCl, CO2, H2O; для предотвращения окисления используют стабилизаторы на основе 1,4-диоксана, диметоксиэтана, алифатич. спиртов и др.
1,1,2-Трихлорэтан получают хлорированием винилхлорида в жидкой фазе в присут. 0,01-0,1% FeCl3 при 20-30 0C либо хлорированием 1,2-дихлорэтана в присут. порофора при 80-90 0C; в последнем случае степень превращения дихлорэтана не должна превышать 40-60%.
1,1,1-Трихлорэтан получают гидрохлорированием винилиденхлорида в жидкой фазе в присут. 0,1-0,5% FeCl3 при 20-30 0C (выход 98-99%), а также хлорированием 1,1-дихлорэтана в газовой фазе при 350-400 0C или в присут. силикагеля, песка, пемзы (без Fe) либо в жидкой фазе в присут. порофора при 80-90 0C или УФ света при 10-30 0C.
СВОЙСТВА ТРИХЛОРЭТАНОВ
| Показатель | 1,1,2-трихлорэтан | 1,1,1-трихлорэтан | |
| T. пл., 0C | -36,5 | -32,8 | |
| T. кип., 0C | 113,9 | 74,1 | |
| | 1,440 | 1,339 | |
| | 1,4714 | 1,4379 | |
| ркрит, МПа | 4,8 | 4,03 | |
| tкрит, oС | 339 | 266 | |
| dкрит, г/см3 | 0,497 | — | |
| | — | 0,86 | |
| | 33,57 (20 0С) | 25,56 (20 0С) | |
| 22,0 (113 0С) | 20,5 (60 0C) | ||
| | 5,17·10-30 | 5,23·10-30 | |
| Давление пара, кПа | 0,13 (-24 0С) | 4,96 (О 0С) | |
| 2,67 (21,6 0C) | 13,13 (20 0С) | ||
| 65,45 (60 0С) | |||
| | 0,659 (25 0С) | 0,669 (0 0C) | |
| жидкости | 1,113 (20 0С) | 1,017 (20 0С) | |
| | -138,5 | -141,84 | |
| | -1099 | -915,4 | |
| | 304,4 | 246 | |
| | 7,29 | 5,64 | |
| Теплопроводность, Вт/(м·К) (20 0C) | 0,135 | 0,1038 |
1,1,2-Трихлорэтан применяют для получения винилиденхлорида. Стабилизир. 1,1,1 -трихлорэтан используют для холодной очистки металлич. поверхностей, в т. ч. содержащих цветные металлы (Al, Cu и др.) и их сплавы, как р-ритель масел, жиров, дегтя, восков и т.д., для обезжиривания электронной аппаратуры, печатных плат, высокочувствит. приборов. 1,1,2-Трихлорэтан - трудногорючая жидкость, т. всп. 29 0C, КПВ 8,7-17,4%; 1,1,1-трихлорэтан взрыво- и пожаробезопасен, т. самовоспл. 570 0C, ПДК в атмосферном воздухе 0,2 мг/м3.
Мировое произ-во 900 тыс. т/год (1990).
Лит. см. при ст. Тетрахлорэтаны. Ю. А. Трегер.

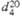
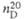
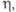 мПа·с(20°С)
мПа·с(20°С)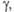 мН/м
мН/м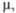 Кл·м
Кл·м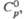 кДж/(кг-К) пара
кДж/(кг-К) пара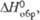 кДж/моль
кДж/моль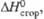 кДж/моль
кДж/моль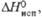 кДж/кг
кДж/кг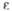 (20 0C)
(20 0C)