Серебра нитрат
СЕРЕБРА НИТРАТ AgNO3, бесцв. кристаллы; до 159,5°С устойчива ромбич. модификация (а = 0,6995 нм, b - 0,7328 нм, с = 1,0118 нм, z= 8, пространств. группа Рbса, плотн. 4,35 г/см3); выше 159,5°С-ромбоэдрич. (а = 0,6287 нм, a = 48,5°, z = 2); DH полиморфного перехода 2,47 кДж/моль; т.пл. 209,7 °С; 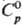 93,0 Дж/(моль·К);
93,0 Дж/(моль·К); 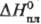 12,1 кДж/моль,
12,1 кДж/моль, 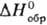 —124,5 кДж/моль;
—124,5 кДж/моль;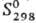 140,9 Дж/(моль· К). Р-римость в воде (г в 100 г): 215,5 (20°С), 471,4 (60°С), 651,9 (80°С); в присут. HNО3 р-римость в воде резко понижается. Легко восстанавливается до Ag° под действием орг., неорг. восстановителей, света, нагревания.
140,9 Дж/(моль· К). Р-римость в воде (г в 100 г): 215,5 (20°С), 471,4 (60°С), 651,9 (80°С); в присут. HNО3 р-римость в воде резко понижается. Легко восстанавливается до Ag° под действием орг., неорг. восстановителей, света, нагревания.
В пром-сти серебра нитрат получают взаимод. Ag (рудного или вторичного) с HNO3 с послед. кристаллизацией из р-ра. Применяют для получения др. соед. Ag, как реагент в арген-тометрии, для серебрения зеркал, как вяжущее бактерицидное ср-во (ляпис), в произ-ве фотографич. эмульсий и др.
П. М. Чукуров.
Комментарии*
Серебра нитрат AgNO₃, бесцветные кристаллы; до 159,5°С устойчива ромбическая модификация (a = 0,6995 нм, b = 0,7328 нм, c = 1,0118 нм, z = 8, пространственная группа Pbca, плотность 4,35 г/см³); выше 159,5°С — ромбоэдрическая (a = 0,6287 нм, α = 48,5°, z = 2); ΔH полиморфного перехода 2,47 кДж/моль; т. пл. 209,7°С; теплоёмкость 93,0 Дж/(моль·К); энтальпия плавления 12,1 кДж/моль, энтальпия образования −124,5 кДж/моль; энтропия образования 140,9 Дж/(моль·К). Растворимость в воде (г в 100 г): 215,5 (20°С), 471,4 (60°С), 651,9 (80°С); в присутствии HNO₃ растворимость в воде резко понижается. Легко восстанавливается до Ag⁰ под действием органических, неорганических восстановителей, света, нагревания. В промышленности серебра нитрат получают взаимодействием Ag (рудного или вторичного) с HNO₃ с последующей кристаллизацией из раствора. Применяют для получения других соединений Ag, как реагент в аргентометрии, для серебрения зеркал, как вяжущее бактерицидное средство (ляпис), в производстве фотографических эмульсий и др. П. М. Чукуров.
Дополнения:
- Ключевые химические свойства: Является сильным окислителем в водных растворах. При взаимодействии с галогенид-ионами (Cl⁻, Br⁻, I⁻) образует характерные нерастворимые осадки галогенидов серебра различного цвета, что используется в качественном анализе.
- Механизм бактерицидного действия: Ионы серебра Ag⁺ связываются с тиоловыми группами ферментов и денатурируют белки бактериальных клеток, нарушая клеточное дыхание и приводя к гибели микроорганизмов.
- Современные применения: Используется в нанотехнологиях для синтеза наночастиц серебра, в производстве проводящих чернил и покрытий в электронике, как катализатор в органическом синтезе.
- Особенности обращения: Соединение токсично, вызывает ожоги кожи и слизистых оболочек. Под действием света постепенно разлагается с выделением металлического серебра, поэтому хранят в тёмных стеклянных бюксах.
*Подобраны с помощью LLM, верифицированы, но возможны неточности.
Синонимы/примеры:*
Ляпис; азотнокислое серебро
*подобраны ИИ, возможны неточности
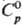 93,0 Дж/(моль·К);
93,0 Дж/(моль·К); 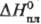 12,1 кДж/моль,
12,1 кДж/моль, 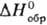 —124,5 кДж/моль;
—124,5 кДж/моль;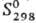 140,9 Дж/(моль· К). Р-римость в воде (г в 100 г): 215,5 (20°С), 471,4 (60°С), 651,9 (80°С); в присут. HNО3 р-римость в воде резко понижается. Легко восстанавливается до Ag° под действием орг., неорг. восстановителей, света, нагревания.
140,9 Дж/(моль· К). Р-римость в воде (г в 100 г): 215,5 (20°С), 471,4 (60°С), 651,9 (80°С); в присут. HNО3 р-римость в воде резко понижается. Легко восстанавливается до Ag° под действием орг., неорг. восстановителей, света, нагревания.
Серебра нитрат AgNO₃, бесцветные кристаллы; до 159,5°С устойчива ромбическая модификация (a = 0,6995 нм, b = 0,7328 нм, c = 1,0118 нм, z = 8, пространственная группа Pbca, плотность 4,35 г/см³); выше 159,5°С — ромбоэдрическая (a = 0,6287 нм, α = 48,5°, z = 2); ΔH полиморфного перехода 2,47 кДж/моль; т. пл. 209,7°С; теплоёмкость 93,0 Дж/(моль·К); энтальпия плавления 12,1 кДж/моль, энтальпия образования −124,5 кДж/моль; энтропия образования 140,9 Дж/(моль·К). Растворимость в воде (г в 100 г): 215,5 (20°С), 471,4 (60°С), 651,9 (80°С); в присутствии HNO₃ растворимость в воде резко понижается. Легко восстанавливается до Ag⁰ под действием органических, неорганических восстановителей, света, нагревания. В промышленности серебра нитрат получают взаимодействием Ag (рудного или вторичного) с HNO₃ с последующей кристаллизацией из раствора. Применяют для получения других соединений Ag, как реагент в аргентометрии, для серебрения зеркал, как вяжущее бактерицидное средство (ляпис), в производстве фотографических эмульсий и др. П. М. Чукуров.
Дополнения: