Алюминия нитрат
АЛЮМИНИЯ НИТРАТ A1(NO3)3, бесцв. дымящие на воздухе кристаллы; т. пл. 66°С (с разл.); плотн. 1,89 г/см3;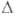 Н°о6р - 927 кДж/моль. Возгоняется в вакууме при 50 С, при более высокой т-ре разлагается до оксинитрата A14O(NO3)6, а затем до А12О3. Взаимод. с эфиром и бензолом со взрывом. Чрезвычайно гигроскопичен. Из водных р-ров при ~ 25 °С кристаллизуется нонагидрат AJ(NO3)3*9H2O - бесцв. расплывающиеся на воздухе кристаллы с моноклинной решеткой (а — 1,086 нм, b = 0,959 нм, с = 1,383 нм,
Н°о6р - 927 кДж/моль. Возгоняется в вакууме при 50 С, при более высокой т-ре разлагается до оксинитрата A14O(NO3)6, а затем до А12О3. Взаимод. с эфиром и бензолом со взрывом. Чрезвычайно гигроскопичен. Из водных р-ров при ~ 25 °С кристаллизуется нонагидрат AJ(NO3)3*9H2O - бесцв. расплывающиеся на воздухе кристаллы с моноклинной решеткой (а — 1,086 нм, b = 0,959 нм, с = 1,383 нм,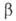 = 95,15°, z = 4, пространств. группа Р21/а); т. пл. 73,6°С;
= 95,15°, z = 4, пространств. группа Р21/а); т. пл. 73,6°С;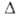 H°обр - 3757 кДж/моль. Выше 73,6°С нонагидрат превращается в окта-, а затем в гексагидрат. При дальнейшем повышении т-ры выделяются HNO3 и оксиды азота и образуются сначала гидроксонитраты А1, а при 200 °С А12О3. Нонагидрат хорошо раств. в воде (73,9 г в 100г при 20°С в расчете на безводный алюминия нитрат), спирте. Безводный алюминия нитрат может быть синтезирован р-цией А1Вг3 с избытком N2O5 с послед, взаимод. образовавшегося NO2[A1(NO3)4] с А1С13. Нонагидрат получают действием разб. HNO3 на А1(ОН)3 или А12О3. Алюминия нитрат применяют в виде нонагидрата и водных р-ров как протраву при крашении тканей, для получения катализаторов, как высаливатель при экстракции соед. актиноидов.
H°обр - 3757 кДж/моль. Выше 73,6°С нонагидрат превращается в окта-, а затем в гексагидрат. При дальнейшем повышении т-ры выделяются HNO3 и оксиды азота и образуются сначала гидроксонитраты А1, а при 200 °С А12О3. Нонагидрат хорошо раств. в воде (73,9 г в 100г при 20°С в расчете на безводный алюминия нитрат), спирте. Безводный алюминия нитрат может быть синтезирован р-цией А1Вг3 с избытком N2O5 с послед, взаимод. образовавшегося NO2[A1(NO3)4] с А1С13. Нонагидрат получают действием разб. HNO3 на А1(ОН)3 или А12О3. Алюминия нитрат применяют в виде нонагидрата и водных р-ров как протраву при крашении тканей, для получения катализаторов, как высаливатель при экстракции соед. актиноидов.
Литература
Широкова Г.Н., Жук С.Я., Росоловский В.Я., "Ж. неорг. химии", 1976, т. 21, № 6, с. 1464-69. В. П. Данилов.
