Окислительно-восстановительный катализ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЙ КАТАЛИЗ, ускорение окислит.-восстановит. р-ций добавками в-в - катализаторов, меняющих свою степень окисления при попеременном взаимод. с реагентами. Такими в-вами м.б. твердые, жидкие или газообразные в-ва-гл. обр. переходные металлы, их соли, оксиды, сульфиды, сольватированные и комплексные ионы переходных металлов в р-рах, оксиды азота. Окислит.-восстановит. взаимод. может протекать в условиях как гетерогенного, так и гомогенного катализа.
Степень окисления атомов катализатора в ходе окислительно-восстановительного катализа может меняться на 1 или 2, напр.: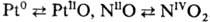 ,
, 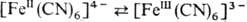 , гидрохинон
, гидрохинон семихинон. В р-рах наиб. распространен окислительно-восстановительный катализ в-вами, степень окисления к-рых изменяется на единицу, т.е. происходит одноэлектрон-ный перенос.
семихинон. В р-рах наиб. распространен окислительно-восстановительный катализ в-вами, степень окисления к-рых изменяется на единицу, т.е. происходит одноэлектрон-ный перенос.
Если один из партнеров окислит.-восстановит. взаимод. -ион переходного металла, электронный перенос может происходить по внутрисферному механизму с промежут. образованием комплекса иона металла с реагентом (р-ции 1 и 2) или по внешнесферному - без образования комплекса (3), напр.:
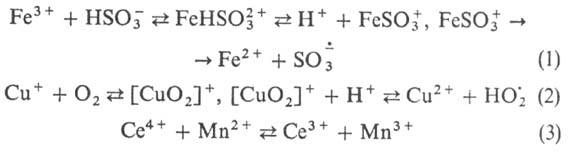
В случае одноэлектронного переноса обычно происходит переход реагентов в свободнорадикальную или ион-радикальную форму. В результате этого в зависимости от значений констант скорости элементарных р-ций радикалов с реагентами и катализатором и их относит. концентраций может осуществляться радикальный или радикально-цепной механизм катализа. В простейшем случае механизм окислительно-восстановительного катализа сводится к замене лимитирующей стадии окислит.-восстановит. взаимод. реагентов двумя более быстрыми р-циями с участием катализатора в разл. окислит.-восстановит. состояниях. Напр., в процессе разложения Н2О2 лимитирующая стадия р-ции 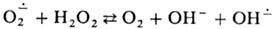 в присут. ионов меди осуществляется след, образом: 1)
в присут. ионов меди осуществляется след, образом: 1)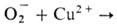 Сu+ + О2; 2) Сu+ + Н2О2
Сu+ + О2; 2) Сu+ + Н2О2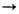 Сu2+ + ОН- + ОН.. В таких р-циях каталитич. цикла, состоящего из двух стадий, сумма изменений своб. энергий
Сu2+ + ОН- + ОН.. В таких р-циях каталитич. цикла, состоящего из двух стадий, сумма изменений своб. энергий 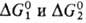 равна значению
равна значению 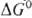 для лимитирующей стадии в некаталитич. р-ции. В зависимости от соотношения
для лимитирующей стадии в некаталитич. р-ции. В зависимости от соотношения 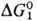 и
и 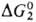 скорость каталитич. процесса будет большей или меньшей. Это связано с существованием зависимости между константой скорости переноса электрона и значением
скорость каталитич. процесса будет большей или меньшей. Это связано с существованием зависимости между константой скорости переноса электрона и значением  для этой р-ции:
для этой р-ции: 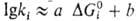 , где kt - константа скорости элементарной р-ции, а и b - эмпирич. коэффициенты. Наиб. эффективным будет тот катализатор, для к-рого значения
, где kt - константа скорости элементарной р-ции, а и b - эмпирич. коэффициенты. Наиб. эффективным будет тот катализатор, для к-рого значения 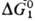 и
и 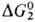 близки.
близки.
При высокой концентрации катализатора значимыми могут стать р-ции эффективного двухэлектронного переноса в результате совместного действия двух одноэлектронных агентов, как, напр., при восстановлении О2 и окислении аскорбиновой к-ты (АН2):
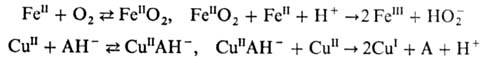
Подобное окислит.-восстановит. взаимод. без промежут. образования своб. радикалов характерно и при объединении одноэлектронных агентов в двух- или многоядерные метал-локомплексы. В этом случае нерадикальный механизм окислительно-восстановительного катализа может осуществляться и при невысоких концентрациях катализаторов. Так, окислительно-восстановительный катализ взаимод. аскорбиновой к-ты с Н2О2 в присут. трехъядерного оксогексаацетатного комплекса [FeIII3О(АсО-)б], для краткости обозначенного 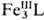 , включает р-ции образования комплекса
, включает р-ции образования комплекса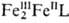 (р-ции 4, 5) и каталитич. цикл р-ций (6, 7):
(р-ции 4, 5) и каталитич. цикл р-ций (6, 7):
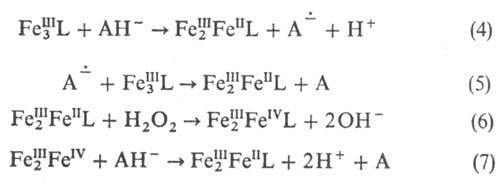
В случае ферментативных и нек-рых модельных систем, включающих неск. одноэлектронных агентов, наблюдается осуществление многоэлектронных окислит.-восстановит. актов: четырехэлектронное окисление О, до Н2О, четырех-электронное восстановление СО до СН3ОН, N2 до N2H4, С2Н2 до С2Нб, шестиэлектронное восстановление N2 до 2 NH3 и др.
Наиб. важные пром. процессы окислительно-восстановительного катализа-окисление SO2 до SO3 (в произ-ве H2SO4) на V2O5 в присут. оксидов азота, окисление NH3 до оксидов азота на Pt, окисление орг. в-в, напр.: n-ксилола на смешанном Mn-Со кат. с образованием терефталевой к-ты, олефинов с образованием альдегидов в присут. СиСl2 и PdCl2.
Процессы окислительно-восстановительного катализа происходят также в атмосфере (окисление СН4 и разложение О3 под действием оксидов азота) и прир. водах при их самоочищении. Все окислит.-восстановит. процессы в живой клетке происходят в результате окислительно-восстановительного катализа металлсодержащими ферментами (см. также Ферментативный катализ).
Лит.: Окислительно-восстановительный катализ ионами металлов, в сб.: Комплексообразование в катализе, т. 13, М., 1968, с. 109-20; Сычев А. Я., Окислительно-восстановительный катализ комплексами металлов, Киш., 1976. А.П.Пурмаль.
