Нитроны
НИТРОНЫ, N-оксиды азометинов, соед. общей ф-лы 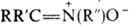 . Различают альдонитроны (R-H, R' и R:-орг. радикалы) и кетонитроны (R, R', R: - орг. радикалы). По номенклатуре ИЮПАК нитроны называют, добавляя слово "оксид" к назв. алкилиденамина, напр.
. Различают альдонитроны (R-H, R' и R:-орг. радикалы) и кетонитроны (R, R', R: - орг. радикалы). По номенклатуре ИЮПАК нитроны называют, добавляя слово "оксид" к назв. алкилиденамина, напр.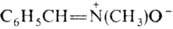 N-бензилиденметиламин-N-оксид. Нитроны изомерны сазиридинам (изонитронам).
N-бензилиденметиламин-N-оксид. Нитроны изомерны сазиридинам (изонитронам).
Нитроны, как правило, кристаллич. в-ва. ИК спектр имеет характеристич. полосу при 1550-1620 см-1 (C=N), в УФ спектрах несопряженных нитронов lмакс 240 нм (lge ~ 4), в спектре ПМР альдонитронов хим. сдвиг (d) ~ 7 м.д. (a-Н), в спектре ЯМР 13С хим. сдвиг a-С-атома ~ 142 м.д.
Электронное строение нитронов может быть представлено резонансными структурами:
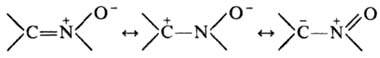
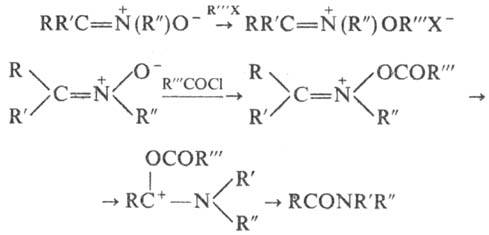
Нитроны-слабые основания, при действии к-т протонируются по атому О с образованием непрочных солей. Алкилирова-ние и ацилирование также происходят по атому О; ацили-рование обычно сопровождается перегруппировкой, приводящей к амидам:
Нитроны вступают в р-ции 1,3-присоединения с нуклеофилами, образуя производные М,М-дизамещенных гидроксиламина; при гидролизе образуются карбонильные соед. и гидро-ксиламины:
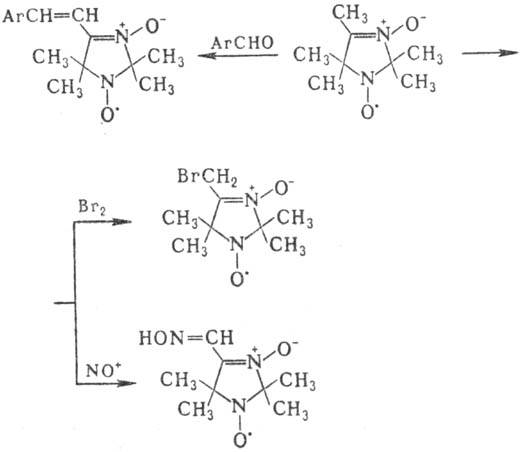
Атомы водорода С-алкильных групп обладают кислыми св-вами: легко обмениваются на дейтерий, галоген, нитро-зогруппу, вступают в конденсацию типа альдольной, напр.:
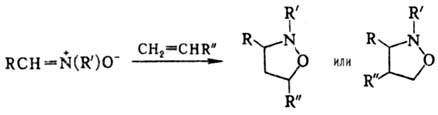
Нитроны легко вступают в р-ции диполярного [3 + 2]-цикло-присоединения с алкенами, диенами и др. Альдонитроны, особенно в случае цис-расположения атомов Н и О, более реакционноспособны, чем кетонитроны. Р-ции позволяют получать с высокими выходами разл. гетероциклич. соед., напр.:
Под действием сильных оснований нитроны претерпевают 1,3-прототропный сдвиг:
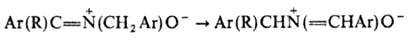
Нек-рые нитроны легко дают циклич. димеры; при УФ облучении изомеризуются в оксазиридины, при нагр. происходит обратная р-ция:
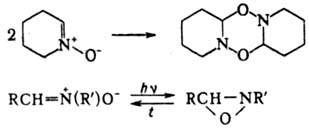
Нитроны устойчивы к действию большинства окислителей. Водный р-р периодата окисляет альдонитроны до N-гидрокси-амидов. Восстановление нитронов комплексными гидридами металлов приводит к N,N-дизамещенным гидроксиламина, а при каталитич. восстановлении образуются азометины и вторичные амины:
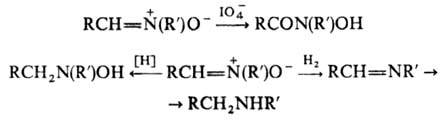
Нитроны реагируют со своб. радикалами с образованием нитро-ксильных радикалов, что используют в методе спиновых ловушек:
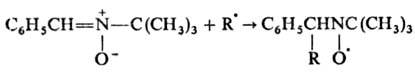
Осн. методы синтеза нитронов: 1) конденсация карбонильных соед. с N-замещенными гидроксиламина:
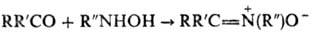
2) алкилирование оксимов алкилгалогенидами или непредельными карбонильными соед., напр.:
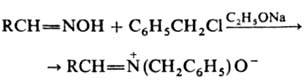
3) конденсация нитрозоароматич. соед. с бензилгалогени-дами или N-метиленпиридиниевыми солями:
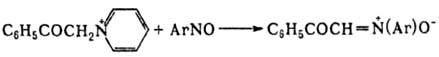
4) окисление N,N-дизамещенного гидроксиламина:
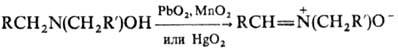
Благодаря доступности и многообразию превращений нитроны широко применяются для синтеза сложных прир. в-в, стабильных нитроксильных радикалов и в изучении механизмов р-ций.
Лит.: Общая органическая химия, пер. с англ., т. 3, М,, 1982, с. 613-18; Имидазолиновые нитроксильные радикалы, Новосиб., 1988; Breuer Eli, The chemistry of functional groups, ed. by S. Patai, pt 1, 1982. Л.Б. Володарский.
