Дегалогенирование
ДЕГАЛОГЕНИРОВАНИЕ, элиминирование галогена из молекулы орг. соед. или замещение его на атом Н. Элиминирование атомов галогена может протекать с отщеплением галогена от соседних атомов С в соед. алифатич. ряда с образованием кратных связей или с отщеплением удаленных друг от друга атомов галогена с образованием циклич. соед. Дегалогенирование находится в равновесии с процессом галогенирования; протеканию дегалогенирования способствует повышение т-ры. Галоген у третичного атома С элиминируется труднее, чем у вторичного или первичного. Скорость дегалогенирования убывает в ряду: I > Вr > Cl > F. Дегалогенирование в газовой фазе, как правило, протекает при 300-400°С (для хлорзамещенных - выше 400 °С). Полигалогениды элиминируют галоген легче, чем моно- или дигалогениды, напр., при 550 °С р-ция С2Сl6 : ССl2=ССl2 + Сl2 полностью сдвинута вправо. Дегалогенирование тетрагалогенметанов протекает по р-циям:
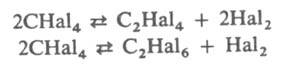
Под действием Zn, Cu, Na, Al, Fe или их солей в спирте, ДМФА, ДМСО и нек-рых др. р-рителях дегалогенирование легко протекает в жидкой фазе и применяется для синтеза непредельных соединений. Дегалогенирование соед. с группами —СНаl2—СНаl2— и —CHal=CHal— под действием гидроксидов или иодидов щелочных металлов приводит к образованию ацетиленов. 1,3-, 1,4- и 1,5-Дигалогениды под действием NaI, KI, Na2Se, соед. Р(Ш) и р-ров щелочи в ацетоне превращаются в циклич. соед., напр.:

Под действием аминов такие алкилгалогениды образуют азотсодержащие гетероциклы, напр.:
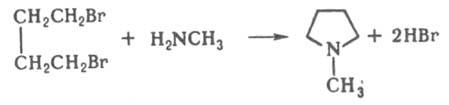
a-Элиминирование атомов галогена от СННаl3 в присут. ионов RO- или ОН- приводит к образованию карбенов, напр.: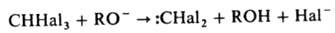
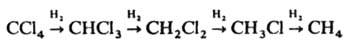
Дегалогенирование в присут. Н2 проводят также электрохимически: RHal + 2e + H+ : RH + Hal-. С ростом числа атомов галогена в молекуле скорость процесса увеличивается. Меняя условия р-ции, можно получать продукты неполного и полного дегалогенирования. Применяют дегалогенирование в осн. для синтеза непредельных соед. Галогенирование с послед. дегалогенированием используется для выделения олефинов из смесей. Литература
