Пирролохинолинохинон (PQQ)
Недавно открыт новый класс белков – хинопротеины, или PQQ-ферменты, содержащие в качестве кофермента неизвестный до сих пор новый ви-таминоподобный фактор пирролохинолинохинон (PQQ). Он имеет следующую структуру:
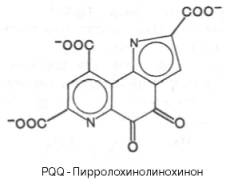
PQQ оказался производным хинона, довольно широко распространенным у микроорганизмов, в животных тканях и растениях. Среди бактериальных ферментов, в состав которых PQQ входит в качестве кофермента, следует указать на метанолдегидрогеназу и алкогольдегидро-геназу. Из тканей животных, растений, грибов и дрожжей выделен медьсодержащий фермент метиламиноксидаза, в котором также есть кова-лентно связанный PQQ в качестве кофермента.
Животные и растительные хинопротеины входят в состав оксидаз и декарбоксилаз (аминоксидаз, диаминоксидаз, монооксигеназ, диокси-геназ). Имеются данные о возможности наличия 2 коферментов: пири-доксальфосфата и PQQ – в составе ряда декарбоксилаз аминокислот (глу-таматдекарбоксилазы и ДОФА-декарбоксилазы).
Интересно отметить, что PQQ-дегидрогеназы и оксидазы по механизму действия аналогичны флавопротеинам, катализирующим перенос 2 электронов и протонов, возможно, непосредственно на убихинон. PQQ-декарбо-ксилазы, напротив, аналогичны по механизму действия пиридоксалевым ферментам, поскольку обе системы содержат карбонильную группу. На примере трехмерной структуры одного из хинопротеинов – метиламино-ксидазы – получены данные, свидетельствующие о том, что коферментом ее является не свободный PQQ, а его предшественник Pro-PQQ (содержит остатки PQQ, индола и глутаминовой кислоты), ковалентно связанный с белковой молекулой.
Как видно на примере PQQ, в природе может встречаться и ряд других незаменимых пищевых факторов, принимающих участие в ключевых реакциях метаболизма, хотя истинные витаминные свойства их, включая PQQ, пока не раскрыты.


