Сортировка белков А. Транспорт белков
Биосинтез белков начинается на свободных рибосомах (на схеме вверху). Однако вскоре пути синтезируемых белков расходятся в соответствии с их функцией: белки, несущие на N-конце сигнальный пептид для ЭР (1), проходят через секреторный путь (на схеме справа), а прочие белки, не имеющие этой сигнальной последовательности, следуют по цитоплазматическому пути (на схеме слева).
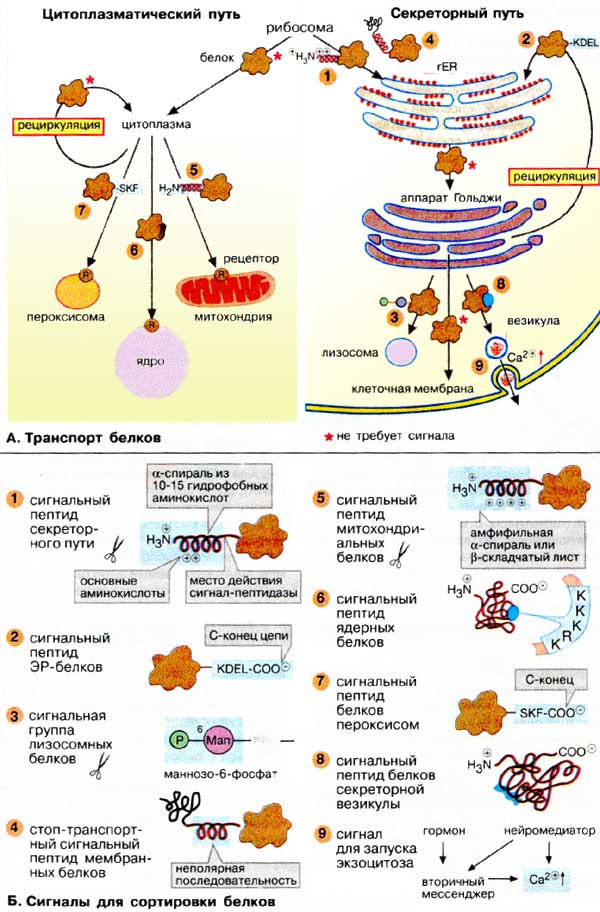
Секреторный путь. Рибосомы, синтезирующие белок с сигнальной для ШЭР последовательностью, связаны с мембраной эндоплазматического ретикулума. Растущая пептидная цепь направляется через мембрану в просвет ШЭР. Последующий путь растущей цепи определяется наличием соответствующего сигнального пептида или сигнального участка.
Белки, имеющие в растущей цепи специальную стоп-сигнальную последовательность (4), остаются в мембране ШЭР в качестве интегрального мембранного белка. По механизму везикулярного транспорта они могут быть перенесены из ШЭР на другие органеллы (см. с. 226).
Белки, попавшие в просвет ШЭР, транспортируются обычным путем в аппарат Гольджи и далее в плазматическую мембрану. Белки, которые остаются в ШЭР, например ферменты модификации белков, возвращаются из аппарата Гольджи в ШЭР с помощью сигнала возврата (2). Прочие белки из аппарата Гольджи попадают в лизосомы (3, см. с. 228) или в плазматическую мембрану (в качестве интегральных мембранных белков или продуктов конститутивного экзоцитоза), либо транспортируются секреторными везикулами (8) в межклеточное пространство (9; регулируемый экзоцитоз).
Цитоплазматический путь. Белки, не имеющие сигнального пептида для ШЭР, синтезируются в цитоплазме на свободных рибосомах и остаются в этом отделе клетки. Для последующего транспорта в митохондрии (5), ядро (6) или пероксисомы (7) белки должны иметь специальные сигнальные последовательности.
Б. Сигналы для сортировки белков
Сигнальные пептиды — это короткие участки, расположенные на N- и С-концах, реже — в центральной части полипептидной цепи. Эти фрагменты имеют характерные физико-химические свойства, такие, как гидрофобный характер, наличие положительного или отрицательного заряда, более важные в функциональном отношении, чем аминокислотная последовательность. Сигнальные участки представляют собой трехмерные структуры на поверхности белка, составленные из различных фрагментов одной и той же или нескольких пептидных цепей. На схеме показаны некоторые из известных сигнальных последовательностей и сигнальных участков. Последовательности даны с использованием однобуквенного кода для аминокислот. Например, последовательность KDEL-COO- (2) определяет сродство белка к мембране ШЭР.
Сигнальные пептиды (участки) — это структурные сигналы, которые могут быть прочитаны клеткой двумя способами. Обычно они узнаются и связываются рецепторами, локализованными в мембранах органелл. Затем рецепторы при участии белков-посредников переносят связанные белки энергозависимым образом через мембраны в соответствующие органеллы, обеспечивая селективность переноса. Кроме того, сигнальные последовательности могут служить местами узнавания для ферментов, которые модифицируют белки, существенно изменяя их свойства и дальнейшую судьбу, в качестве примера можно привести белки лизосом или мембранные белки с липидным якорем.
Сигнальные пептиды, расположенные на N- или С-концах полипептидной цепи, после выполнения своей функции удаляются специфичными гидролазами. На схеме эти ферменты показаны в виде ножниц. При наличии в белке нескольких сигнальных последовательностей они удаляются поочередно. Это имеет место, например, в случае импорта белков в митохондрии и хлоропласты, когда большинству белков приходится последовательно проходить через несколько мембран.


