§ 1. Связывание «металлических ядов» биологическим материалом
Причину отравлений соединениями металлов долгое время объясняли образованием в организме так называемых альбуминатов. Однако сторонники этой гипотезы химизм образования, состав и прочность альбуминатов не приводят.
Благодаря успехам в области биологической химии, фармакологии, токсикологии и ряда других наук установлено, что в организме ионы металлов связываются не только с белковыми веществами, но и с аминокислотами, пептидами и рядом других жизненно важных веществ. Прочность образовавшихся при этом соединений (комплексов) зависит от природы металлов, наличия соответствующих функциональных групп в молекулах веществ, связывающихся с металлами, природы связи в образовавшихся соединениях или комплексах и т. д.
Связывание ионов металлов аминокислотами. Аминокислоты являются структурными элементами, из которых построены белки и которые определяют многие важные свойства этих белков. В настоящее время известно значительное число аминокислот. Однако в состав белков входит только около двадцати α-аминокислот. Все аминокислоты (кроме пролина), входящие в состав белков, содержат свободную карбоксильную группу и свободную незамещенную аминогруппу у α-углеродного атома. Пролин имеет замещенную α-аминогруппу и представляет собой α-иминокислоту.
Способность ионов металлов взаимодействовать с аминокислотами зависит от наличия в их составе определенных атомов и функциональных групп. С ионами металлов могут взаимодействовать концевые амино- и карбоксильные группы аминокислот. Большая роль в образовании связей между ионами металлов и аминокислотами принадлежит и боковым функциональным группам аминокислот. К числу боковых функциональных групп в аминокислотах относятся: спиртовые группы в молекулах се-рина и треонина, фенильная группа в тирозине, сульфгидрильная группа в цистеине, дисульфидная группа в цистине, вторые карбоксильные группы в аспарагиновой и глутаминовой кислотах, вторые азотсодержащие группы в аргинине и гистидине. Метионин содержит атомы серы в углеродной цепи.
В зависимости от наличия определенных групп атомов в молекулах аминокислот, природы и химических свойств металлов при взаимодействии между ними могут образовываться связи различной прочности.
Аминокислоты в водных растворах и в кристаллическом состоянии находятся в виде биполярных ионов:
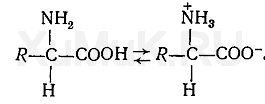
Аминокислоты являются амфотерными соединениями. Диссоциация их на ионы зависит от рН среды. В кислой среде аминокислоты диссоциируют как основания, в щелочной — как кислоты:
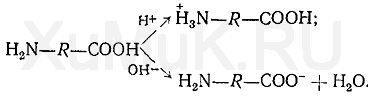
Катионы металлов взаимодействуют с анионами аминокислот. В аминогруппах аминокислот содержатся атомы азота, имеющие неподеленную пару электронов, за счет которой образуется координационная связь между катионом металла и атомом азота. Эту связь следует рассматривать как один из видов ковалентной связи. При образовании координационной связи между катионом металла и атомом азота донором обоих связывающих электронов является атом азота аминогруппы.
Один атом кислорода в карбоксильной группе аминокислоты после ее диссоциации имеет отрицательный заряд. За счет этого атома кислорода катионы металлов с аминокислотой могут образовывать как ионные, так и ковалентные связи. Характер этих связей зависит от природы катионов. При взаимодействии отрицательно заряженных атомов кислорода в карбоксильных группах с катионами щелочных металлов возникают ионные связи (образуются соли), а с катионами тяжелых металлов — ковалентные связи.
Катионы металлов, являющиеся комплексообразователями, с аминокислотами образовывают внутрикомплексные соединения (хелаты). При этом положительные заряды катионов нейтрализуются отрицательными зарядами атомов кислорода в карбоксильных группах, а незаряженные атомы азота аминогрупп с катионами металлов образовывают координационные связи.
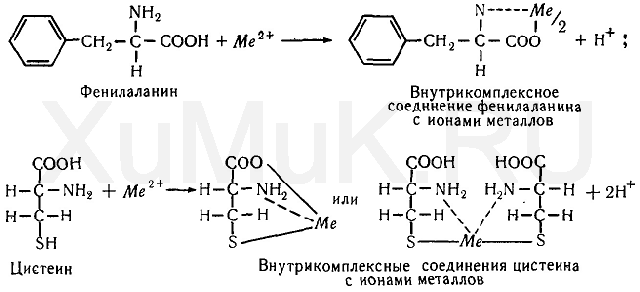
Катионы металлов также могут связываться с боковыми реакционноспособными функциональными группами (—SH,—NH 2, — СООН) аминокислот с образованием внутрикомплексных соединений. Из аминокислот большой способностью связывать металлы обладают гистидин, содержащий в молекуле имидазольное кольцо, и цистеин, в молекуле которого имеется сульфгидрильная группа.
Образование внутрикомплексных соединений катионов металлов с аминокислотами можно показать на примере фенилаланина и цистеина;
Связывание металлов пептидами. Пептиды представляют собой продукты конденсации аминокислот, связанные между собой пептидными (амидными) связями (—NH—СО—). Приставки ди-, три-, тетра- и т. д. соответствуют числу остатков аминокислот в молекулах пептидов. Пептиды, включающие 20 и больше остатков аминокислот, называются полипептидами. Молекулярная масса их достигает 5000. Полипептиды с большей молекулярной массой называются белками.
Ди- и трипептиды могут связывать катионы металлов за счет образования связей с концевыми карбоксильными и аминными группами. Пептиды, представляющие собой продукты конденсации большого числа молекул аминокислот, не могут связываться с металлами указанными концевыми группами, так как эти группы значительно удалены друг от друга. Поэтому такие пептиды связываются с катионами металлов в основном за счет образования связей с боковыми функциональными группами или же с концевой карбоксильной группой и с атомом азота амидной группы, близко расположенной к карбоксильной группе. Координационная связь металла с атомом азота амидной группы менее прочная, чем связь металла с азотом аминной группы. Это объясняется тем, что электронодонорные свойства атома азота амидной (пептидной) группы выражены значительно слабее, чем у азота аминной группы.
При образовании связей между ионами металлов и пептидами-донорами электронов могут быть не только атомы азота, ко и атомы серы, находящиеся в дисульфидных мостиках.
Связывание металлов белками. Белки занимают центральное место в структуре живой материи и играют первостепенную роль в ее функционировании. В количественном отношении белки представляют собой основной материал тканей живых организмов. Белки составляют до 75 % сухой массы клеток.
Белки представляют собой макромолекулы с молекулярными массами от 5000 до нескольких миллионов. Они состоят из α-аминокислот, связанных между собой пептидными (амидными) связями, образованными карбоксильными и аминными группами соседних аминокислотных остатков.
В образовании связей с металлами могут принимать участие концевые амино- и карбоксильные группы белковых молекул. Однако число концевых групп в молекулах белков незначительное. Каждая молекула белка, представляющая длинную полипептидную цепь, содержит только две значительно удаленные друг от друга концевые (—NH 2 и —СООН) группы и большое число боковых функциональных групп. Поэтому образование связей между ионами металлов и белками происходит в основном за счет боковых функциональных групп (—SH, —NH 2, —ОН, —СООН). Полагают, что металлы связываются с белками главным образом через остатки гистидина, содержащего имидазольное кольцо, и цистеина, имеющего боковую сульфгидрильную группу.
Выше приведены сведения о связывании ионов металлов с аминокислотами, пептидами и белками в организме. Однако металлы могут связываться в организме и с другими соединениями, играющими важную роль во всех живых клетках. К таким соединениям относятся птеридины (в том числе фолиевая кислота), пурины, рибофлавин, нуклеиновые кислоты и многие др. В большинстве случаев ионы металлов с перечисленными выше соединениями образовывают прочные ковалентные связи.
При отравлениях соединениями металлов на химико-токсикологическое исследование могут поступать органы трупов, биологические жидкости и другие объекты биологического происхождения. Для изолирования «металлических ядов» из указанных объектов, в которых эти яды находятся в виде прочных соединений с аминокислотами, пептидами, белками и другими веществами, необходимо производить разрушение (минерализацию) органических веществ, а затем в минерализатах обнаруживать и определять количественное содержание соответствующих «металлических ядов».


