Трииода (I) нитрида аммиакат
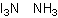
Синонимы:
азота иодистого аммиакат Внешний вид:
черн. ромбические кристаллыБрутто-формула (система Хилла): H3N2I3
Формула в виде текста: NI3 NH3
Молекулярная масса (в а.е.м.): 411,75
Температура разложения (в °C): 26
Продукты термического разложения:
иодРастворимость (в г/100 г или характеристика):
вода: не растворимэтанол: не растворим
Плотность:
3,5 (20°C, г/см3)Дополнительная информация:
 В сухом виде сильно взрывоопасен. Детонирует от незначительных воздействий. Сублимирует в вакууме.
В сухом виде сильно взрывоопасен. Детонирует от незначительных воздействий. Сублимирует в вакууме.
Разлагается растворами тиосульфатов, тиоцианатов, цианидов. Разлагается горячей водой до аммиака, иода и иодата аммония, разбавленным раствором едкого натра - до иодата и иодида натрия и аммиака, концентрированной серной кислотой - до диоксида серы, иодной кислоты и сульфата аммония.
Реагирует с диэтилцинком с образованием аммиака, триэтиламина и этилцинкиодида. В жидком аммиаке иодирует ацетилен до дииодацетилена (выход до 97%), в водном растворе дает продукты присоединения иода к ацетилену. С метилкетонами образует иодоформ. Количественно иодирует фенолы и нитрофенолы, труднее и с образованием побочных продуктов иодируются оксибензойные кислоты.
Окисляет гидрохинон до хингидрона, бензальдегид до бензойной кислоты.
- "Реакции и методы исследования органических соединений" кн.6, М.: ГНТИХЛ, 1957 стр. 40-41
- "Справочник химика" т.2, Л.-М.: Химия, 1964 стр. 14-15
- Лидин Р.А., Молочко В.А., Андреева Л.Л. "Химические свойства неорганических веществ" М.:Химия, 2000 стр. 278
- Реми Г. "Курс неорганической химии" т.1 М. 1963 стр. 669
- Чувурин А.В. "Занимательная пиротехника" ч.1 Харьков: Основа, 2003 стр. 182-183
