Свойства оксиальдегидов, оксикетонов и моносахаридов
Низшие представители этих классов — обычно бесцветные жидкости, многоатомные оксиальдегиды и оксикетоны — кристаллические вещества, иногда густые сиропы; они очень хорошо растворимы в воде, хуже — в спирте, нерастворимы в эфире. Многие из них обладают сладким вкусом, свойственным сахаристым веществам.
Ввиду того что большая часть реакций моноз отвечает их оксиальдегидной или оксикетонной формам, свойства моносахаридов будут излагаться вместе со свойствами оксиальдегидов и оксикетонов с использованием для удобства ациклических формул. Лишь в тех случаях, когда обнаруживаются особенности свойств моносахаридов, зависящие от их циклического строения, будут использоваться циклические окисные формулы.
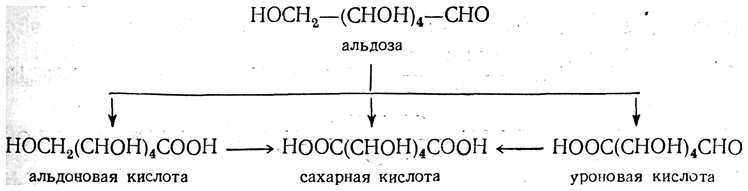
1. Окисление. Оксиальдегиды и монозы легко окисляются, причем в зависимости от условий получаются весьма разнообразные продукты окисления. Осторожным окислением оксиальдегидов можно получить одноосновные оксикислоты с тем же числом атомов углерода; из альдоз получаются альдоновые кислоты.
Для получения альдоновых кислот окисление альдоз обычно проводят в кислой среде хлором, бромом, гипохлоритом, разбавленной азотной кислотой. При более энергичном окислении альдоз, например концентрированной азотной кислотой, помимо альдегидной группы, окисляется первичная спиртовая и образуются двухосновные оксикислоты, так называемые сахарные кислоты. Продуктами окисления альдоз являются также уроновые кислоты, например глюкуроновая, образующаяся из глюкозы, галактуроновая — из галактозы и т. д. При образовании уроновых кислот окисляется первичный спиртовый гидроксил альдозы и в конце цепи образуется карбоксильная группа, тогда как альдегидная группа остается неизмененной:
При окислении оксикетонов, а также при менее осторожном окислении оксиальдегидов происходит расщепление их молекул.
При окислении моносахаридов в щелочной среде происходит их глубокое расщепление с образованием ряда продуктов, в том числе очень легко окисляющихся. Поэтому моносахариды, так же как оксиальдегиды и α-оксикетоны, у которых гидроксильная группа находится при атоме углерода, соседнем с карбонильной группой, являются сильными восстановителями. Подобно альдегидам, они восстанавливают аммиачную окись серебра с образованием металлического зеркала, а также фелингову жидкость с образованием красной закиси меди.
Восстановление фелинговой жидкости моносахаридами применяется для их количественного определения объемным методом (по количеству израсходованной фелинговой жидкости) или весовым методом (по количеству осевшей закиси меди).
2. Восстановление. Осторожное восстановление оксиальдегидов, оксикетонов и моноз ведет к получению соответствующих многоатомных спиртов, в том числе (из моноз) тетритов, пентитов, гекситов и пр.
3. Присоединение синильной кислоты. Оксиальдегиды, оксикетоны и монозы присоединяют синильную кислоту, образуя нитрилы высших глюконовых кислот:
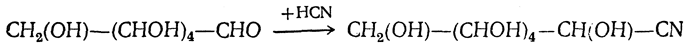
4. Действие гидроксиламина. При действии гидроксиламина получаются оксимы моноз, например:
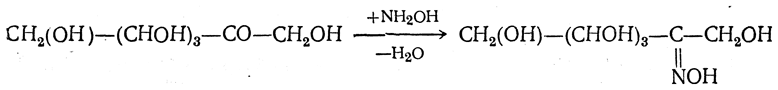
5. Действие фенилгидразина. Одной из наиболее важных реакций, которая позволяет выделять в чистом виде отдельные монозы, а также устанавливать тождество моноз различного происхождения, является взаимодействие моноз с фенилгидразином. В первую очередь фенилгидразин действует на монозы так же, как на простейшие альдегиды и кетоны, т. е. с выделением воды и образованием фенилгидразона:
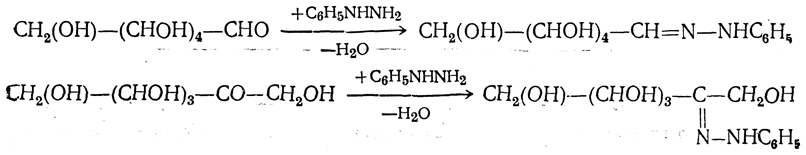
При нагревании полученных гидразонов с фенилгидразином или при нагревании моноз с избытком фенилгидразина сначала соседняя с карбонильной группой первичная или вторичная спиртовая группа окисляется в карбонильную, причем фенилгидразин восстанавливается до анилина и аммиака. Вновь образовавшаяся карбонильная группа (для кетоз — альдегидная, а для альдоз — кетонная) вступает в реакцию с третьей молекулой фенилгидразина, и получаются так называемые озазоны моноз
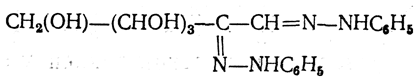
Описанный механизм образования озазонов, постулированный Э. Фишером, в последние годы подвергся проверке. Казалась мало вероятной вторая фаза реакции — восстановление фенилгидразина (до аммиака) столь слабым восстановителем, как вторичная спиртовая группа фенилгидразона. Было предложено несколько различных вариантов механизма реакции, из которых наиболее достоверным является следующий (Вейганд; М. М. Шемякин и В. М. Майминд):
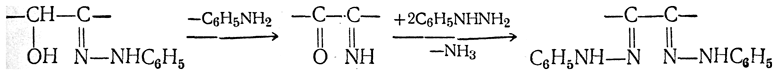
Из альдоз и кетоз могут получиться озазоны одинакового строения, если конфигурации незатронутых при реакции асимметрических атомов в молекулах альдозы и кетозы одинаковы, как, например, у глюкозы и фруктозы.
Гидразоны и озазоны моноз обычно хорошо кристаллизуются. Некоторые гидразоны и многие озазоны трудно растворимы в воде, благодаря чему их легко выделить в кристаллическом виде из водных растворов моноз.
Интересно, что метилфенилгидразин
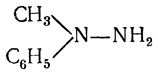
дает озазоны только с кетозами, с альдозами же образует лишь легко растворимые гидразоны, что и позволяет с помощью метилфенилгидразина отделять альдозы от кетоз.
При действии кислот на гидразоны происходит реакция, обратная реакции образования гидразонов, т. е. присоединяется молекула воды и образуются исходная моноза и фенилгидразин. Озазоны при действии кислот могут отщеплять обе молекулы фенилгидразина, давая так называемые озоны СН2(ОН)—(СНОН)3—СО—СНО, содержащие рядом две карбонильные группы.
Аналогичные реакции с фенилгидразином дают все простейшие оксиальдегиды и оксикетоны, содержащие гидроксильную группу рядом с карбонильной. Так, глицериновый альдегид дает гидразон
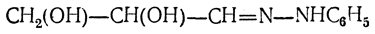
и озазон
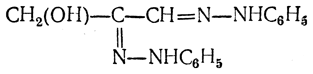
Тот же озазон получается и из диоксиацетона.
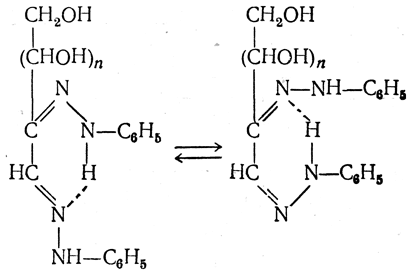
До настоящего времени окончательно не установлено, почему при образовании озазонов реакция останавливается на присоединении двух остатков фенилгидразина, почему не происходит окисления у третьего углеродного атома, присоединения третьего остатка фенилгидразина и т. д.
Это явление пытаются объяснить тем, что после введения двух остатков фенилгидразина возможна стабилизация молекулы вследствие образования водородной связи и замыкания за этот счет шестичленного цикла в одной из его таутомерных форм:
Для идентификации сахаров их озазоны можно превратить путем кипячения с CuSO4 в производные триазола, так называемые озотриазолы
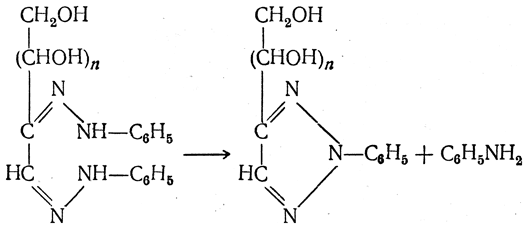
имеющие более высокие температуры плавления, чем исходные озазоны.
При взаимодействии фенилгидразона альдозы с солью диазония в холодном пиридиновом растворе выпадает блестящий красный кристаллический осадок формазана, существующего в виде хелатного соединения:
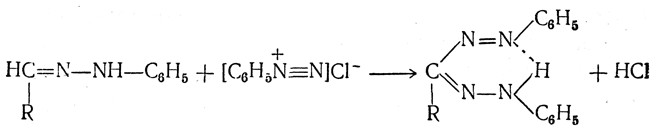
Образование формазанов, обладающих четкими температурами плавления, является хорошим методом идентификации сахаров, имеющим преимущества перед реакцией образования озазонов: возникает возможность отличать альдозы от кетоз, не дающих формазанов, а также различать эпимерные альдозы, дающие одинаковые озазоны.
Окисление формазанов дает соли тетразолия:
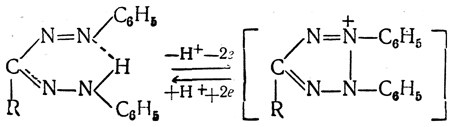
Тетразолиевые соли, производные сахаров, при малой токсичности обладают бактерицидностью. Они легко (в животных тканях) восстанавливаются в исходные формазаны. Превращение хорошо растворимых бесцветных солей тетразолия в яркоокрашенные нерастворимые формазаны используется для количественного определения восстанавливающих сахаров (стр. 644 и 649), а также при изучении процессов биологического восстановления в тканях.
6. Действие щелочей. Оксиальдегиды, оксикетоны и монозы весьма чувствительны к действию щелочей. Так, например, глюкоза уже при действии разбавленных щелочей на холоду частично превращается в стереоизомерную альдозу (маннозу) и в кетозу (фруктозу). Аналогично, фруктоза частично превращается в глюкозу и маннозу, а манноза — в глюкозу и фруктозу. Легкость превращения моноз в щелочной среде объясняется тем, что, как было показано спектроскопическими исследованиями в ультрафиолетовой области, в этих условиях значительно повышается содержание в растворе оксо-формы, отличающейся наибольшей химической активностью.
При указанных превращениях, открытых еще Лобри де Брюином и Ван-Экенштейном (1897), сначала образуется промежуточная енольная форма, которая в свою очередь может образоваться из оксо-формы:
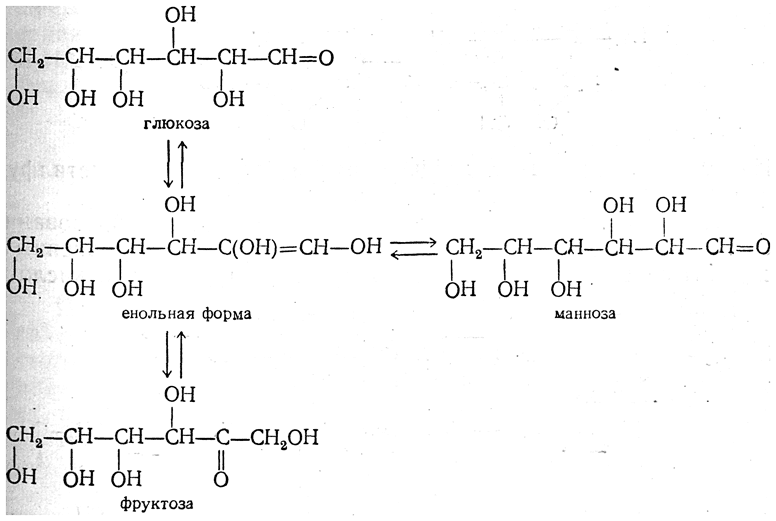
Как видно из схемы, конфигурация второго углеродного атома, характерная для глюкозы, маннозы и фруктозы, исчезает при превращении их в енольную форму, из которой могут образоваться все три монозы.
Подобные превращения могут претерпевать все моносахариды. Происходящее при этих превращениях изменение конфигурации второго углеродного атома альдоз носит название эпимеризации, а альдозы, отличающиеся лишь конфигурацией второго углеродного атома, называются эпимерами. Эпимеры дают одинаковые озазоны.
На енолизацию и взаимные превращения моноз в щелочной среде оказывает влияние не только концентрация ионов гидроксила, но и характер катиона щелочи (А. М. Кузин, С. А. Балезин).
При нагревании моноз со щелочами, как и в случае альдегидов, происходит побурение и осмоление моноз, сопровождающееся их частичным окислением. При этом образуется большое число продуктов расщепления, конденсации, полимеризации и т. д. При нагревании глюкозы и фруктозы со щелочами одним из важнейших продуктов расщепления язляется молочная кислота; образуется также муравьиная кислота и другие вещества.
7. Действие кислот. Действие кислот на пентозы и гексозы может быть использовано для их распознавания, а именно: при нагревании пентоз с разбавленными кислотами легко отщепляется вода и образуется летучий гетероциклический альдегид — фурфурол:
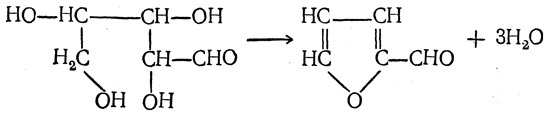
Из метилпентоз аналогичным путем получается метилфурфурол.
Действие кислот на гексозы ведет сначала к образованию оксиметилфурфурола, который при кипячении с разбавленными кислотами разлагается на левулиновую и муравьиную кислоты:
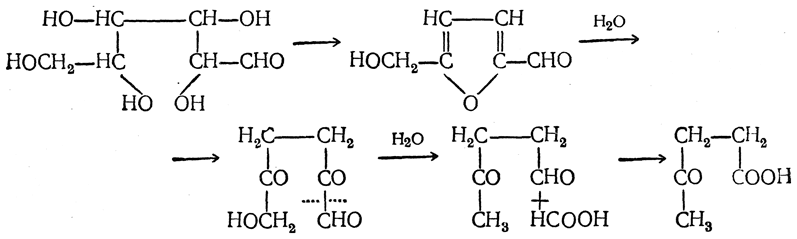
Поскольку производные фурфурола дают с рядом веществ окрашенные продукты конденсации, способность моносахаридов образовывать при действии высококонцентрированных кислот фурфурол или его производные используется для качественного обнаружения и количественного (колориметрического) определения сахаров. Для этого продукты реакции моносахаридов с кислотами подвергаются конденсации с фенолами, карбазолом или другими реагентами. В последние годы для этой цели очень часто пользуются также реакцией с антроном, дающим с углеводами в присутствии H2SO4 синее окрашивание. Эта реакция применяется для определения не только восстанавливающих, но и невосстанавливающих сахаров, поскольку в присутствии серной кислоты происходит их гидролиз.
8. Окрашивание фуксинсернистой кислоты. Простейшие оксиальдегиды (гликолевый и глицериновый альдегиды) дают окрашивание с фуксинсернистой кислотой при обычных условиях. Альдозы дают окрашивание лишь с фуксинсернистой кислотой, приготовленной особым образом.
9. Замещение атомов водорода гидроксильных групп. Присутствие гидроксильных групп в молекулах моноз обнаруживается соответствующими типическими реакциями:
а) При действии щелочей и даже при действии окислов тяжелых металлов легко получаются производные моносахаридов типа алкоголятов, называемые сахаратами.
б) Действием на монозы ангидридов кислот может быть получен ряд сложных эфиров моноз, вплоть до полного эфира, в котором атомы водорода во всех гидроксильных группах замещены на кислотные остатки. Например, при полном ацетилировании гексоз могут быть получены пентаацетилгексозы С6Н7О(ОСОСН3)5. Подобно гликозидам, пентаацетилгексозы существуют в двух стереоизомерных формах (α- и β-), например:
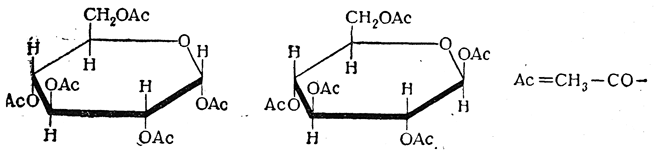
При действии хлористого или бромистого водорода на пентаацетильные соединения гексоз, а также при действии хлористого ацетила на монозы полуацетальный гидроксил (ацетилированный или свободный) замещается аа галоид. Получающиеся при этом ацетогалогенозы, например ацетохлорглюкоза и ацетобромглюкоза, также существуют в α- и β-формах:
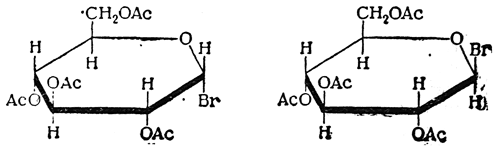
Ацетогалогенозы играют важную роль в синтезах гликозидов и других производных сахаров.
в) Атомы водорода в гидроксильных группах моноз могут быть замещены углеводородными радикалами. Так, например, при действии метилирующих агентов [(CH3)2SO4; CH3J] замещение может произойти во всех пяти гидроксилах глюкозы:
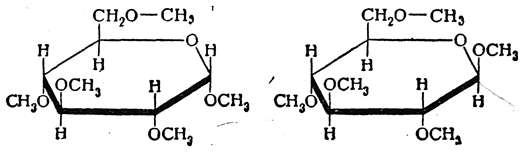
Полученное пентазамещенное производное иногда называют пентаметилглюкозой, но правильнее называть его тетраметилметилглюкозидом.
Метильные группы, замещающие атомы водорода во всех гидроксилах, кроме полуацетального, связанные по типу простых эфиров, стойки к гидролизу (щелочному и кислотному), отличаясь в этом отношении от метильной группы, присоединенной за счет полуацетального гидроксила. Метилированные производные моноз сыграли очень важную роль при установлении строения моносахаридов и полисахаридов.
г) Замещение в монозах атома водорода в полуацетальном гидроксиле на радикал приводит к образованию гликозидов — веществ, широко распространенных в природе.
Синтетически простейшие гликозиды можно получить взаимодействием монозы и спирта в присутствии сухого хлористого водорода. Для получения гликозидсв более высокомолекулярных спиртов или ароматических оксисоединений пользуются другим методом: конденсацией пентаацетилзамещенной монозы со спиртом получают тетраацетилпроизводное гликозида, которое омыляют в щелочной среде, и выделяют свободный гликозид (Гельферих). Гликозиды можно получить также, исходя из ацетогалогеноз, которые путем замещения галоида на алкоксил превращают в тетраацетилзамещенные гликозиды, а затем ацетильные группы омыляют (Кенигс и Кнорр).
Гликозиды представляют собой кристаллические вещества или сиропы; метилированные гликозиды перегоняются в высоком вакууме без разложения. Будучи в большинстве случаев стойки к щелочам, гликозиды гидролизуются кислотами, распадаясь на сахар и несахарную компоненту, носящую название
агликона. Гликозиды легко гидролизуются также под действием ферментов, носящих название гликозидаз.
Скорость кислотного гидролиза гликозидов сильно зависит от их строения. Так, фуранозиды гидролизуются кислотами приблизительно в 100 раз быстрее, чем пиранозиды. Особенно специфичен ферментативный гидролиз: α-гликозиды расщепляются только α-гликозидазами (например, содержащейся в дрожжах), а β-гликозиды — только β-гликозидазами (например, содержащейся в ферментном препарате эмульсине, получаемом из горьких миндалей). Изучение скорости гидролиза гликозидов (кислотного и ферментативного) дает важные сведения для решения вопроса о том, является ли данный гликозид производным пиранозы или фуранозы, α- или β--формы.
10. Конденсация моноз с альдегидами и кетонами. Под влиянием конденсирующих средств (H2SO4, CuSO4 и т. д.) монозы дают с альдегидами и кетонами ацеталеподобные соединения, которые приобрели большое значение для установления строения и конфигурации моноз и полисахаридов и для синтеза последних. Особенно важны соединения с ацетоном, причем для гексоз известны моно- и диацетонпроизводные.
Ацетонпроизводные моносахаридов, которые называются также изопропилиденпроизводными, образуются преимущественно таким образом, что каждая изопропилиденовая группа замещает атомы водорода двух соседних гидроксилов, находящихся в цис-положении. Так, например, диацетонгалактоза образуется по следующей схеме:
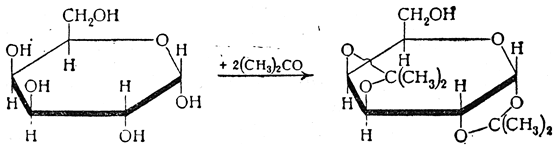
Она имеет строение 1,2-3,4-диизопропилиденгалактопиранозы.
Если в равновесном растворе сахара хотя бы в небольшом количестве содержится таутомерная форма с двумя парами соседних гидроксилов в цис-положении, то в реакцию с ацетоном вступает именно эта форма, в которую постепенно переходят другие таутомеры. Так, хотя в растворе глюкозы преобладают пиранозы, при реакции с ацетоном получается диацетонглюкофураноза, поскольку глюкопиранозы не имеют двух пар цис-гидроксилов;
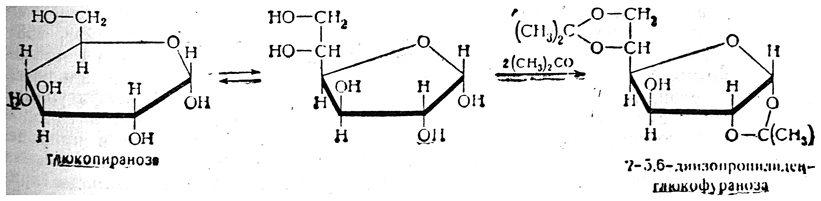
При осторожном кислотном гидролизе диацетонпроизводных получаются монсацетонпроизводные. Например, из 1,2-5,6-диизопропилиденглюкозы получается 1,2-изопропилиденглюкофураноза
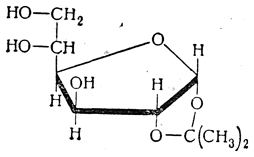
Указанные закономерности образования ацетонпроизводных моноз не всегда соблюдаются. Если в молекуле нет двух пар цис-расположеныых гидроксилов и они не могут образоваться при таутомерных превращениях (например, в случае ацетонирования глюкозидов), изопропилиденные группы могут присоединяться и иначе. Так, например, при ацетонировании метилα-маннопиранозида образуется 2,3-4,6-диизопропилиденманнопиранозид
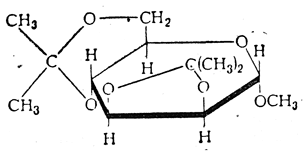
Ацетонпроизводные стойки к щелочам, но легко гидролизуются разбавленными кислотами; гидроксильные группы, оставшиеся свободными после ацетонирозания, могут быть метилированы, ацилированы, замещены на галоид и т. д. Ацетонпроизводные могут быть применены для синтеза производных моноз с определенным положением заместителей или непосредственно, или же после осторожного гидролиза с отщеплением ацетона. Так как многие ацетонпроизводные имеют фуранозое кольцо (по указанным выше причинам), их часто используют для синтезов производных фураноз.
11. Брожение. Очень многие оксиальдегиды и оксикетоны способны под влиянием некоторых микроорганизмов претерпевать химические превращения, известные под названием брожений (спиртовое, маслянокислое, молочнокислое и уксусное брожение). Замечательно, что наиболее легко подвергаются брожению вещества с числом атомов углерода в молекуле, кратным трем, т. е. глицериновый альдегид, диоксиацетон, гексозы и нонозы. Брожение гексоз различной конфигурации происходит с неодинаковой легкостью, причем из двух оптических антиподов обычно легче подвергаются брожению антиподы, встречающиеся в природе. Пользуясь этим обстоятельством, удалось выделить из многих синтетических оптически недеятельных моноз неизвестные ранее оптические антиподы природных соединений.


