Особенности реакционной способности галоидвинильных соединений
Когда вещества, содержащие сопряженные двойные связи, вступают в реакции, то наряду со статическим эффектом сопряжения проявляется также динамический эффект сопряжения, который обычно играет преобладающую роль. Он выражается в перераспределении электронной плотности в системе (поляризуемость молекулы) в момент химической реакции под влиянием атакующего реагента. Динамический эффект в молекулах с сопряженными связями, по-видимому, оказывает такое же влияние на реакционную способность вещества, как и статический эффект, и обычно их нелегко различить. Поэтому динамическое влияние также изображают изогнутыми стрелками.
Примером реакции, в которой проявляется динамический эффект сопряжения, может служить взаимодействие галоидоводородных кислот с бутадиеном: молекула бутадиена, сама по себе неполярная, поляризуется под влиянием ионов Н+ и X–:
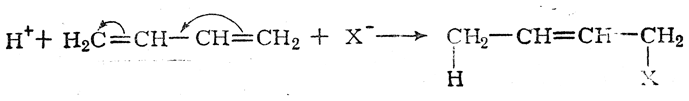
В большинстве случаев статические и динамические факторы действуют согласованно, способствуя какому-нибудь одному направлению реакции. Однако известны примеры, когда статические и динамические факторы действуют в противоположных направлениях; в таких случаях, как правило, решающее влияние оказывают динамические факторы. Так, например, присоединение бромистого водорода к хлористому винилу происходит в соответствии с правилом Марковникова
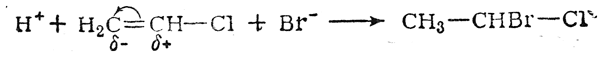
в то время как нереагирующая молекула хлористого винила, без сомнения, поляризована так, что наиболее гидрогенизованный атом углерода несет положительный заряд:
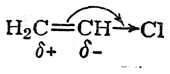
Ясно, что в реакции хлористого винила с бромистым водородом статический фактор (характер поляризации двойной связи под влиянием атома хлора) должен благоприятствовать присоединению НВr против правила Марковникова.
Для того чтобы составить суждение о динамических факторах данной реакции, необходимо рассмотреть два переходных состояния. Переходное состояние I возникает при атаке молекулы хлористого винила протоном в соответствии с правилом Марковникова
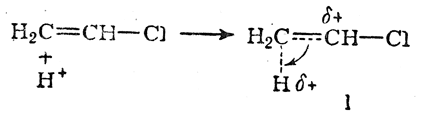
а состояние II — при атаке протоном против правила Марковникова
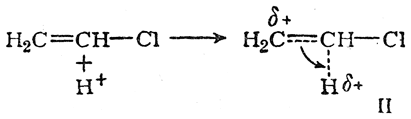
В обоих случаях вследствие смещения электронной плотности по направлению к протону его заряд уменьшается, а на соответствующем углеродном атоме возникает положительный заряд (увеличивающийся по мере приближения протона к молекуле хлористого винила). В результате энергия переходного состояния в обоих случаях повышается. Однако в переходном состоянии I положительный заряд на углеродном атоме может быть частично компенсирован смещением внешнего электронного облака атома хлора
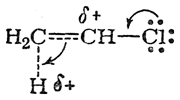
вследствие чего положительный заряд еше более делокализуется (в некоторой степени положительно заряженным становится и атом хлора). В отличие от этого в переходном состоянии II положительный заряд, возникающий на углеродном атоме метиленовой группы, не может компенсироваться смещением электронного облака атома хлора, так как последний находится слишком далеко. Локализация положительного заряда на углеродном атоме обусловливает более значительную энергию системы, чем в переходном состоянии I. Поэтому реакция будет протекать не через переходное состояние II, а через переходное состояние I с меньшей энергией активации, т. е. по правилу Марковникова, несмотря на противодействие статического фактора.
Однако влияние статического фактора сказывается на скорости реакции. Действительно, приближение протона к углеродному атому, несущему вследствие статического эффекта сопряжения некоторый положительный заряд, естественно затруднено
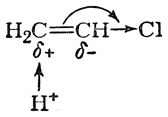
а потому скорость реакции присоединения НВr к хлористому винилу во много раз меньше скорости присоединения того же реагента к незамещенному этилену.
Следует отметить, что в литературе довольно распространена ошибка в трактовке строения и реакционной способности хлористого винила.
Нереагирующую молекулу хлористого винила часто изображают следующим образом:
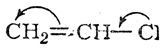
В этой формуле подкупает кажущаяся простота одновременного объяснения и инертности галоида и присоединения к хлористому винилу галоидоводородов в соответствии с правилом Марковникова. Однако указанная формула ошибочна.
Это становится очевидным, если сравнить распределение электронной плотности в молекулах этилена и хлористого винила:

В молекуле этилена плотность π-электронов распределяется симметрично. Введение же в эту молекулу электроотрицательного атома хлора вместо атома водорода нарушает электронную симметрию. π-Электронная пара смещается по направлению к атому хлора, на котором электронная плотность становится наибольшей
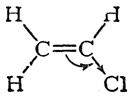
а не наименьшей, как следовало бы из приведенной выше ошибочной формулы.


