§ 5. Подгруппа германия
Содержание элементов этой подгруппы в земной коре по ряду германий (2·10–4 %) – олово (6·10–4 %) – свинец (1·10–4 %) изменяется лишь незначительно. Германий принадлежит к весьма рассеянным элементам. Основной формой природного нахождения олова является минерал касситерит (SnO2 ), а свинца – галенит (PbS).
Германий обычно получают как побочный продукт при переработке некоторых цинковых руд. Выплавка олова ведется путем восстановления касситерита углем. Обычным способом переработки галенита является перевод его путем накаливания на. воздухе в РbО, после чего полученная окись свинца восстанавливается до металла углем:
2PbS + ЗО2 = 2SO2 + 2PbO
и
РbО + С = СО + Рb
По физическим свойствам Ge, Sn и Рb являются типичными металлами. Некоторые их константы сопоставлены ниже:

Твердость и хрупкость рассматриваемых элементов быстро уменьшаются по ряду Ge–Sn–Pb: в то время как германий довольно тверд и очень хрупок, свинец царапается ногтем и прокатывается в тонкие листы. Олово занимает промежуточное положение. Все элементы подгруппы германия дают сплавы между собой и со многими другими металлами. В некоторых случаях при сплавлении образуются химические соединения (например, типа Mg2 Э).
1) Металлический германий находит важное, но ограниченное по объему применение в радиотехнике. Олово используется главным образом для лужения железа с целью предохранения его от ржавления («белая жесть» консерзной промышленности). Свинец применяется для изготовления аккумуляторных пластин, обкладок электрических кабелей, пуль и дроби, для защиты от рентгеновского излучения и гамма–лучей, а также как коррозионностойкий материал в химической промышленности (трубопроводы и т. д.). Очень большие количества олова и свинца расходуются на изготовление ряда технически важных сплавов. Ежегодная мировая добыча олова составляет около 200 тыс. т, а свинца – около 2 млн. т.
2) Кроме обычного олова (плотность 7,3), известны еще две аллотропические кодификации этого элемента. Ниже +13°С устойчива серая порошкообразная Форма с плотностью 5,8. Скорость перехода в нее обычного олоза очень мала.
Поэтому такой переход, сопровождающийся превращением оловянного предмета в серый порошок, при охлаждении олова обычно не присходит. Однако он наблюдается на некоторых старинных сосудах и медалях из олова.
Выше 161 °С олово переходит (при 200 °С уже довольно быстро) в модификацию с плотностью 6,6, характеризующуюся большой хрупкостью. Поэтому н гретое выше 200 °С олово можно легко растереть в мелкий порошок.
Под действием кислорода воздуха германий и олово не изменяются, а свинец окисляется. Поэтому свинцовые предметы не имеют блестящего металлического вида. Пленка окисла в обычных условиях хорошо предохраняет металл от дальнейшего окисления, но при нагревании оно идет дальше и свинец постепенно окисляется нацело. При нагревании на воздухе начинает окисляться и олово. Германий взаимодействует с кислородом лишь выше 700 °С. Все три элемента способны соединяться с галоидами и серой.
Вода не действует на германий и олово. Со свинца она постепенно снимает окисную пленку и тем способствует его дальнейшему окислению. В ряду напряжений Ge располагается между медью и серебром, a Sn и Pb перед водородом. Лучшим растворителем свинца является разбавленная азотная кислота, герхмания и олова – царская водка. Взаимодействие с ней обоих элементов идет по схеме:
ЗЭ + 4HNO3 + 12НСl = ЗЭСl4 + 4NO + 8Н2 О
Все производные свинца сильно ядовиты.
3) Отношение элементов подгруппы германия к отдельным кислотам существенно различно. Соляная кислота не действует на германий. Олово лишь очень медленно растворяется в разбавленной НСl, тогда как с концентрированной легко (особенно при нагревании) идет реакция по уравнению:
Sn + 2HCl = SnCl2 + H2
Свинец при взаимодействии с НСl покрывается слоем труднорастворимого PbСl2 , препятствующим дальнейшему растворению металла. Аналогично идет взаимодействие свинца и с серной кислотой, однако лишь до тех пор, пока концентрация ее не превышает 80%. При более высоких концентрациях H2 SO4 образуется растворимая кислая соль Pb(HSO4)2 уже не защищающая свинец от дальнейшего действия кислоты. На германий разбавленная серная кислота не действует, на Sn – почти не действует. В горячей концентрированной H2 SO4 оба элемента растворяются по схеме:
Э + 4H2 SO4 = Э(SО4 )2 + 2SO3 + 4Н2 О
При действии на Ge азотной кислоты образуется осадок гидрата двуокиси – хGеО2 ·Н2 О. Аналогично–по схеме Sn+ 4HNO3 = SnO2 + 4NO2 +2H2 O действует концентрированная азотная кислота и на олово. Напротив, в сильно разбавленной холодной HNO3 олово медленно растворяется с образованием Sn(NО3 )2 . Водород при этом не выделяется, а идет на восстановление азотной кислоты. При действии HNO3 на свинец, по реакции 3Pb + 8HNO3 = 3Pb(NO3 )2 + 2NO + 4H2 O образуется Pb(NО3 )2 . Соль эта нерастворима в концентрированной НNО3 и предохраняет металл от дальнейшего действия кислоты. Напротив, в воде она хорошо растворима, и поэтому в разбавленной азотной кислоте свинец легко растворяется.
Растворы щелочей на германий почти не действуют. Олово и свинец медленно растворяются в сильных щелочах по схеме Э + 2NaOH = Na2 ЭO2 + H2 . Растворимостью олова в щелочах пользуются для снятия его со старых консервных банок, после чего металл выделяют из раствора электролитически. Ввиду высокой стоимости олова его регенерация (обратное получение) имеет большое экономическое значение.
Характерные для германия и его аналогов положительные валентности 4 и 2. Поэтому известны два ряда производных рассмагриваемых элементов, Для германия гораздо более типичны соединения, в которых он четырехвалентен. У олова различие Появляется менее резко, хотя при обычных условиях производные четырехвалентного Sn более устойчивы. Напротив, для свинца значительно более типичны соединения, в которых он двухвалентен. В связи с этим производные двухвалентных Ge и Sn являются восстановителями (притом очень сильными), а соединения четырехвалентного Pb – окислителями (также очень сильными). Но переход от более низкой к более высокой положительной валентности, как правило, легче идёт в щелочной среде, а обратный переход – в кислой. Поэтому восстановительные свойства двухвалентных Ge и Sn в щелочной среде выражены сильнее, чем в кислой, а четырехвалентный Pb, будучи очень сильным окислителем в кислой среде, в щелочной таковым не является.
Для элементов подгруппы германия известны окислы типов ЭО и ЭО2 . Первые называют обычно окисями, вторые – двуокисями. При накаливании на воздухе Ge и Sn образуются их в ы с–шие окислы, а при накаливании Pb – низший. Остальные могут быть получены лишь косвенным путем. Например, PbO2 обычно получают взаимодействием уксуснокислого свинца с хлорной известью по уравнению:
Pb(СН3 СОО)2 + Са(Сl)ОСl + Н2 О = PbО2 + СаСl2 + 2СН3 СООН
Все рассматриваемые окислы представляют собой твердые вещества, причем GeO и SnO характеризуются черной окраской, PbO – желтовато–красной, GeO2 и SnO2 –белой, PbО2 –темно–коричневой.
Так как с водой эти окислы почти не соединяются, отвечающие им гидроокиси обычно получают действием сильных щелочей на растворы соответсвующих солей, например:
SnCl4 + 4NaOH = 4NaCl + Sn(OH)4
Pb(NO3)2 + 2NaOH = 2NaNO3 + Pb(OH)2
Они выделяются в виде осадков белого – Sn(OH)4 , коричневого – Ge(OH)2 и бурого – Pb(OH)2 цветов.
По химическим свойствам все рассматриваемые гидроксиды представляют собой амфотерные соещинения.
Характерность того или иного направления диссоциации отдельных представителей видна из следующего сопоставления:
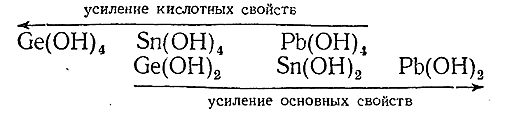
Наиболее отчетливо кислотные свойства выражены у гидрата двуокиси германия, который все же является очень слабой кислотой. Основные свойства наиболее отчетливо выражены у Pb(ОН)2 , который сообщает воде заметную щелочную реакцию.
Ввиду своего амфотерного характера рассматриваемые гидроокиси растворяются и в сильных щелочах и в кислотах. При действии на них щелочей образуются соли кислот типа Н2 ЭО3 или Н2 ЭО2 , содержащие Ge, Sn или Pb в составе аниона, а при действии кислот – соли этих элементов с катионами Э2+ или Э4+.
От гидрата PbОг, как кислоты, и Pb(ОН)2, как основания, производятся два смешанных окисла свинца – Pb2 Оз (т. н, закись–окись) оранжевого цвета и Pb3 О4 (т. н. сурик) ярко–красного цвета. Первый является свинцовой солью м ет асвинцовой (Н2 PbО3 ), второй – ортосвинцовой кислоты (Н4 PbО4 ). Таким образом, оба окисла – PbPbО3 и Pb2 PbО4 –содержат в своем составе атомы свинца различной валентности. В воде они практически нерастворимы.
Ввиду слабости основных свойств гидратов двуокисей Ge, Sn и Pb их производные с катионами Э4+ подвергаются в растворах сильному гидролизу. Наибольшее значение имеют галоге–ниды типа ЭГ4 , которые известны для всех рассматриваемых элементов и галоидов кроме PbВr4 и PbJ4 ).
По физическим свойствам они (кроме SnF4 и PbF4 ) напоминают скорее не типичные соли, а аналогичные соединения Si и С. Например, SnCl4 является бесцветной жидкостью (т. пл. –32 °С, т. кип. 114°С).
Самым характерным химическим свойством галогенидов ЭГ4 является их склонность к реакциям присоединения. Так, SnCl4 образует комплексы с Н2 О, NH3 , окислами азота, РСl5 и т. д., равно как со многими органическими веществами. Весьма устойчивы комплексы большинства галогенидов ЭГ4 с галоидоводородными кислотами (главным образом типа H2 [ЭГ6 ]) и производные от подобных комплексных кислот соли. Например, раствор (NH4 )2 [SnCl6 ] показывает нейтральную реакцию на лакмус.
Соли кислородных кислот для двухвалентного олова (и германия) малохарактерны. Из них SnSO4 используется при электролитическом лужении (т. е. покрытии других металлов оловом). Подобно остальным производным Sn2+, соль эта ядовита.
В противоположность аналогичным соединениям олова соли двухвалентного свинца восстановителями не являются. Большинство их бесцветно и труднорастворимо в воде. Из часто встречающихся в практике хорошо растворяются 'только азотнокислая [Pb(NO3 )2 ] и уксуснокислая [Pb(СН3 СОО)2 ].
Отвечающие типам 3S и 3S2 сульфиды рассматриваемых элементов могут быть получены (кроме PbS2 ) как сухим путем (исходя из элементов), так и действием сероводорода на содержащие ионы Э2+или Э4+ растворы соответствующих солей. В последнем случае образуются осадки следующих цветов:
GeS2 – белый
SnS2 – желтый
GeS – буро–красный
SnS – бурый
PbS – черный
В воде и разбавленных кислотах рассматриваемые сульфиды практически нерастворимы. Исключение представляет GeS2 , слегка растворимый в воде и гидролитически разлагающийся ею. Сульфиды типов ЭS и ЭS2 существенно отличаются друг от друга по своему отношению к сернистому ахммонию. В то время как на первые он не действует, вторые переводятся им в раствор с образованием аммонийных солей тиогерманиевой (H2 GeS3 ) и тиооловянной (H2 SnS3 ) кислот по схеме:
(NH4 )2 S + 3S2 = (NH4 )2 ЭS3
Эти тиокислоты в свободном состоянии неустойчивы. Поэтому при подкислении растворов их солей происходит отщепление H2 S и осаждение сульфида ЭS2 :
(NH4 )2 ЭS3 + 2НСl – 2NH4 Cl + H2 S + ЭS2
Несколько особняком в химии Ge, Sn и Pb стоят их водородные соединения. Для двухвалентных элементов они не характерны. Для четырехвалентных устойчивость их в ряду Ge–Sn–Pb Уменьшается настолько быстро, что существование PbH4 могло быть только доказано (по летучести свинца при его соприкосновении с атомарным водородом), но в индивидуальном состоянии он не получен. Гидриды германия и олова образуются как незначительные примеси к водороду при разложении кислотами сплавов этих элементов с магнием. От водорода они могут быть отделены охлаждением смеси газов жидким воздухом.
По физическим свойствам GeH4 и SnH4 похожи на аналогичные соединения Si и С. Они также представляют собой бесцветные газы с низкими температурами плавления и кипения, как это видно из приводимого ниже сопоставления.

При хранении гидриды германия и олова постепенно разлагаются на элементы. Оба они чрезвычайно ядовиты.


