Аммония фосфаты
АММОНИЯ ФОСФАТЫ. Дигидроортофосфат (моноаммонийфосфат) NH4H2PO4 - бесцв. кристаллы (см. табл.) с тетрагон. решеткой (а = 0,750 нм, с = 0,755 нм); Нопл35,6 кДж/моль; Sо298 152 Дж/(моль*К); разлагается с выделением NH3; давление разложения (Па): 8,0 (125,1°С), 36,0 (144,9°С, 1340 (170,0°С); насыщ. р-ра 0,857 мПа*с (20°С).
Нопл35,6 кДж/моль; Sо298 152 Дж/(моль*К); разлагается с выделением NH3; давление разложения (Па): 8,0 (125,1°С), 36,0 (144,9°С, 1340 (170,0°С); насыщ. р-ра 0,857 мПа*с (20°С).
СВОЙСТВА ФОСФАТОВ АММОНИЯ 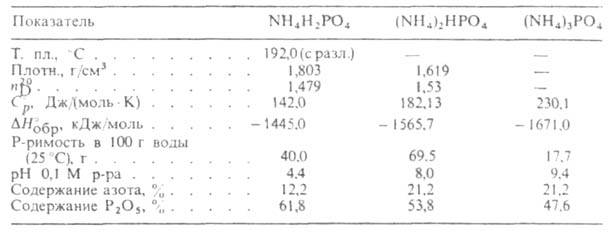
Гидроортофосфат (диаммонийфосфат) (NH4)2HPO4 -бесцв. кристаллы с моноклинной решеткой (а = 1,0735 нм, b = 0,6689 нм, с = 0,8000 нм, = 109,72 °С); разлагается с выделением NH3, давление разложения (Па): 26,7 (50 °С), 146,8 (70 °С), 760 (90 °С).
= 109,72 °С); разлагается с выделением NH3, давление разложения (Па): 26,7 (50 °С), 146,8 (70 °С), 760 (90 °С).
Ортофосфат (триаммонийфосфат) (NH4)3PO4 - бесцв. твердое в-во; при 30-40°С разлагается с выделением NH3. Практич. применения не имеет.
Аммония фосфаты входят в состав удобрений [NH4H2PO4 осн. компонент аммофоса, (NН4)2НРО4 - диаммофоса], флюсов при пайке олова, бронзы, меди, цинка. Кристаллич. NН4Н2РО4 - пьезо- и сегнетоэлектрик; (NH4)2HPO4-антипирен для древесины, бумаги, тканей; его применяют также для приготовления пищ. дрожжей и фосфатирования металлов. Мировое произ-во моно- и диаммонийфосфатов 9,4 млн. т/год (без СССР; в пересчете на Р2О5; 1981).
Лит. см. при ст. Аммофос. А. А. Бродский.

Дополнения:
Моноаммонийфосфат (NH₄H₂PO₄):
Диаммонийфосфат ((NH₄)₂HPO₄):
Общие свойства:
Современное производство: