Литийорганические соединения
ЛИТИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ, содержат связь Li—С. Низшие AlkLi, где Alk = СН3, С2Н5, трет-C4H9, - бесцв. кристаллы, Alk = C7-С12 - вязкие жидкости, высшие -низкоплавкие парафинообразныс в-ва; хорошо раств. в углеводородах (кроме CH3Li) и эфиpax. Литийорганические соединения RLi, где R = Ar, алкинил, - бесцв. или желтоватые твердые неплавкие в-ва; не раств. в углеводородах, раств. в эфирах. Литийорганические соединения, где R = (СН2)nАr, - желтые, оранжевые или красные твердые в-ва, по р-римости аналогичны ArLi. В твердой и газовой фазе и в р-ре молекулы RLi ассоциированы, степень ассоциации 4, реже 2, 6. В среде сильно сольватирующих р-рителей, образующих хелаты, ассоциация RLi (кроме CH3Li) подавляется, и литийорганические соединения существуют в таких р-рах в виде мономеров или димеров. Природа связи С—Li в растворенных литийорганических соединениях зависит от природы R и р-рителя и может меняться от полярной ковалентной многоцентровой до ионной; в системе могут присутствовать контактные ионные пары R-Li+, сольватно-разделенные ионные пары R-|S|Li+ (S - p-ритель) и ионы R-, Li+. По хим. св-вам литийорганические соединения близки к реактивам Гриньяра. Разлагаются при нагр. по типу b- или (реже) a-элиминирования, напр.: CH3Li при 250 °С разлагается на СН4 и CH2Li2, выше 250°С - на C2Li2, LiH и Li; C4H9Li в кипящем октане дает СН3СН2СН=СН2, С4Н10 и LiH. Литийорганические соединения окисляются О2 воздуха. Выделенные в чистом виде CH3Li и C2H5Li мгновенно сгорают со вспышкой; с увеличением числа атомов С в R способность к самовоспламенению убывает, C4H9Li уже не загорается на воздухе. Соед. ArLi тлеют на воздухе, м- и n-HalArLi взрывоопасны. Осторожное окисление эфирных р-ров литийорганических соединений О2 приводит после гидролиза к орг. гидропероксидам. Вода, влажные р-рители, влага воздуха, минер. к-ты, спирты, тиоспирты разлагают р-ры литийорганических соединений. Индивидуальные литийорганические соединения реагируют с Н2О крайне энергично. Р-цию C2H5Li + Н2О : LiOH + С2Н6 используют для определения малых кол-в воды в углеводородах. Разложение литийорганических соединений действием D2O - удобный метод введения D в орг. молекулы. С галогенами литийорганические соединения в р-ре образуют RHal и LiHal, при восстановлении Н2 при повыш. давлении - RH и LiH, с простыми эфирами (в случае АlkLi - олефины, AlkH и алкоголяты Li. С ТГФ литийорганические соединения дают после гидролиза R(CH2)4OH. С СО при низких т-рах RLi образуют кетоны R2CO, при комнатной т-ре - сложную смесь соед., с СО2 после гидролиза -RCOOH. С формальдегидом RLi дают (после гидролиза продукта р-ции) первичные спирты, с др. альдегидами -вторичные, с кетонами и сложными эфирами - третичные спирты:
СН2О + RLi : RCH2OH;
R'COX + RLi : RR'XCOH;
X = H, R:, OR': По сравнению с реактивами Гриньяра литийорганические соединения имеют преимущество при синтезе стерически затрудненных спиртов. С нитрилами R'CN и иминами R2C=NR: литийорганические соединения образуют (после гидролиза продукта р-ции) соотв. кетоны RCOR' и амины, напр.:
RLi + R'2C=NR: : R'2CRNHR:
Литийорганические соединения присоединяются по связям С=С. Р-ция легко протекает для сопряженных кратных связей, при этом возможно 1,2-, 3,4- и 1,4-присоединение (см. схему). Бутиллитий присоединяется к изопрену стереоспецифично по 1,4-типу. В случае изолированных кратных связей требуются спец. условия (хелатирующие добавки, давление).
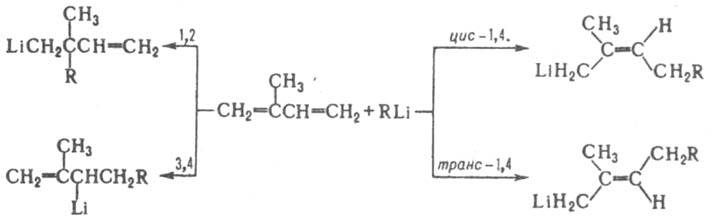
Взаимод. литийорганических соединений с сопряженными диенами и стиролом, вызывающее полимеризацию, нашло применение в пром-сти. Получают и используют литийорганические соединения в виде р-ров в углеводородах, реже - в диэтиловом эфире. Индивидуальные литийорганические соединения получают упариванием их р-ров в вакууме или р-цией Li с R2Hg. Ниже описаны осн. способы получения литийорганических соединений. 1. Взаимод. алкилбромидов или алкилхлоридов с Li в орг. р-рителе. Для получения CH3Li и C6H5Li м. б. использованы соотв. СН3I и С6Н5I. Р-ция протекает по механизму одноэлектронного переноса с промежут. образованием анион-радикала RHal', распад к-рого на пов-сти Li дает RLi. В результате побочных р-ций могут образовываться R—R, RH и олефины. 2. Металлирование углеводородов литийорганическими соединениями, обычно действием CH3Li, C4H9Li, смеси C4H9Li с mpem-C4H9OK, иногда LiNR'2: RH + R'Li D RLi + R'H. Равновесие р-ции смещено в сторону образования литийорганического соединения более кислого углеводорода. Р-ции способствует увеличение основности среды, напр. бензол плохо металлируется в обычных условиях, но легко при добавлении хелатирующего амина (CH3)2NCH2CH2N(CH3)2. 3. Обменная р-ция: RHal + R'Li D RLi + R'Hal. Обычно R' = Alk, R = Ar, алкенил. В результате р-ции образуется литийорганическое соединение, орг. часть к-рого наиб. эффективно делокализует отрицат. заряд. Скорость р-ции увеличивается в ряду F < Сl < Вr ~ I и с ростом основности среды. 4. Р-ция переметаллирования RnM + nLi : nRLi + M или RnM + nR'Li : nRLi + Rn'M, где М - менее электроположит. элемент (Hg, Si, Sn, Pb, Sb, Cd, Bi, Zn). Метод используют для синтеза бензильных, аллильных, винильных, функциональнозамещенных литийорганических соединений. 5. Присоединение металлич. Li к сопряженным диенам первоначально приводит к литийорганическим соединениям, напр., типа LiCH2—CR=СН—CH2Li, к-рые являются инициаторами анионной полимеризации диенов. 6. Взаимод. АrН с металлич. Li, обычно в диэтиловом эфире, приводит к сильно окрашенным литийорганическим соединениям типа парамагнитных [АrН]'Li+ (м. б. выделены в присут. краун-эфиров) и диамагнитных [ArH]2-2Li+. Соед. этого типа менее характерны для литийорганических соединений, чем для натрийорг. соединений. Применяют литийорганические соединения в орг. синтезе как алкилирующие и металлирующие агенты, в пром-сти - в качестве инициаторов стереоспецифич. полимеризации диенов и сополимеризации непредельных соединений. Литература
