Энтальпия образования
ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ (теплота образования), энтальпия р-ции образования данного в-ва (или р-ра) из заданных исходных в-в. Энтальпия образования хим. соединения наз. энтальпию р-ции образования данного соед. из простых в-в. В качестве простых в-в выбирают хим. элементы в их естественном фазовом и хим. состоянии при данной т-ре. Так, при 298 К для хлора простым в-вом служит газообразный хлор, состоящий из молекул С12, а для калия - металлич. К. Энтальпия образования твердого КС1 при 298 К - это энтальпия р-ции:
К(тв.) + 1/2С12= КС1(тв.).
Энтальпия образования КС1 (тв.) при 500 К соответствует р-ции: К(жидкий) + 1/2C12 = КС1(тв.), т. к. естественным фазовым состоянием (простым в-вом) для калия становится уже не кристалл, а жидкость (т-ра плавления К 336,66 К).
Энтальпия образования может быть определена при любой т-ре. Стандартные энтальпии образования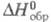 соответствуют р-циям образования, при к-рых и простые в-ва, и получающееся соед. находятся при давлении 1 атм (1,01 x 105 Па). По определению, для всех простых в-в при любой т-ре
соответствуют р-циям образования, при к-рых и простые в-ва, и получающееся соед. находятся при давлении 1 атм (1,01 x 105 Па). По определению, для всех простых в-в при любой т-ре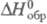 = 0 (см. Стандартное состояние). Для большинства хим. соед. энтальпии образования- отрицат. величины.
= 0 (см. Стандартное состояние). Для большинства хим. соед. энтальпии образования- отрицат. величины.
Единицы измерения энтальпии образования- Дж/г, Дж/моль.
В термодинамике р-ров (расплавов) под энтальпией образования понимают изменение энтальпии при изотермо-изобарном образовании 1 моля (1 г) р-ра (расплава) данного состава из чистых компонентов. Так, в двухкомпонентной системе KF-A1F3 энтальпия образования расплава 50 %-ного молярного состава соответствует процессу: 1/2КF(жидкий) + 1/2А1F3(жидкий) = КF-А1F3(расплав, 50 мол. %).
Определение стандартных энтальпий образования смесей возможно при любой т-ре, как и энтальпий образования хим. соединений. Энтальпию образования смеси данного состава наз. часто энтальпией смешения. Неидеальные р-ры характеризуются избыточной энтальпией образования, к-рая представляет собой разницу между реальной энтальпией образования фазы данного состава и энтальпией образования гипотетич. идеального р-ра того же состава (см. Растворы неэлектролитов).
Энтальпии образования определяют экспериментально калориметрич. измерениями. Второе и третье начала термодинамики позволяют получать энтальпии образования из эксперим. данных. Теоретич. расчеты энтальпий образования хим. соед. пока неосуществимы. Возможны эмпирич. оценки энтальпии образования, напр., из энтальпий образования родственных соединений.
Энтальпии образования хим. соединений табулированы в термодинамич. справочниках и банках информации.
М. В. Коробов.
