Цинка сульфат
ЦИНКА СУЛЬФАТ ZnSO4, бесцв. кристаллы ромбич. сингонии (а = 0,6731 нм, b = 0,8581 нм, с = 0,4760 нм, z = 4, пространств. группа Рпта); плотн. 3,54 г/см3;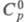 99,14 Дж/(моль x К);
99,14 Дж/(моль x К);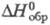 -982,01 кДж/моль;
-982,01 кДж/моль;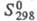 110,62 Дж/(моль x К); при нагр. до 600-800 °С разлагается до SO3 и оксосульфатов, выше 930 °С образуется ZnO. Раств. в воде и глицерине. Р-римость в воде растет почти линейно с т-рой от 27,6% по массе при -7 °С до 41,4% при 39 °С. В этом интервале т-р кристаллизуется гептагидрат ZnSO4 x 7H2O (цинковый купорос) с ромбич. решеткой. При 39-70 °С кристаллизуется гексагидрат, р-римость цинка сульфата при этом 47,7% (70 °С). Выше 70 °С образуется моногидрат, р-римость цинка сульфата падает до 44% (105 °С). Моногидрат обезвоживается при 238 °С. Известны также нестабильные тетра-, ди- и гептагидраты (моноклинной сингонии).
110,62 Дж/(моль x К); при нагр. до 600-800 °С разлагается до SO3 и оксосульфатов, выше 930 °С образуется ZnO. Раств. в воде и глицерине. Р-римость в воде растет почти линейно с т-рой от 27,6% по массе при -7 °С до 41,4% при 39 °С. В этом интервале т-р кристаллизуется гептагидрат ZnSO4 x 7H2O (цинковый купорос) с ромбич. решеткой. При 39-70 °С кристаллизуется гексагидрат, р-римость цинка сульфата при этом 47,7% (70 °С). Выше 70 °С образуется моногидрат, р-римость цинка сульфата падает до 44% (105 °С). Моногидрат обезвоживается при 238 °С. Известны также нестабильные тетра-, ди- и гептагидраты (моноклинной сингонии).
Описаны основные сульфаты Zn, напр. 3Zn(OH)2 x ZnSO4 х 4Н2О, а также кислый цинка сульфат ZnSO4 x H2SO4, кристаллизующийся из 95%-ного р-ра H2SO4. Известны также двойные сульфаты: Na2SO4 x ZnSO4 x 4H2O, K2SO4 x ZnSO4 x 6H2O и др.
Цинка сульфат получают из вторичного сырья и из руд при обработке H2SO4. Образующийся р-р применяют в произ-ве вискозы, как микроудоорение и добавку к кормам, компонент электролита при получении Zn электролизом и при цинковании, как флотореагент, компонент глазных капель, для пропитки древесины, отбеливания бумаги.
Лит.: Позин М. Е., Технология минеральных солей, 4 изд., ч. 1, Л.,1974, с. 714-28.
В. П. Данилов.
