6.5. Влияние различных факторов на мицеллообразование
Обычно рассматривают два основных фактора, влияющих на мицеллообразование, - взаимодействие углеводородных радикалов между собой, способствующее ассоциации, и электростатическое отталкивание полярных ионизированных групп.
Следует помнить, что характер взаимодействия у ионных и неионогенных веществ с растворителем (водой) различный, что придает их растворам различные свойства. Наличие диссоциирующей в водном растворе ионной группы, непосредственно связанной с углеводородным радикалом, и относительно свободных противоионов, способных разрушать структуру воды, наряду со структурирующими воду метиленовыми группами в гидрофобной части одной молекулы, приводит к антагонистическому воздействию отдельных частей одной молекулы на состояние растворителя в разбавленных растворах ионогенных ПАВ. Кроме того, при определенном пространственном расположении молекул этих веществ между заряженными группами может проявляться электростатическое взаимодействие. Однако необходимо учитывать и возможность образования ионных двойников из поверхностно-активных ионов и противоионов и, следовательно, нейтрализацию заряда ионизированных молекул ПАВ.
Неионогенные ПАВ свободны от структурного антагонизма, но, с другой стороны, они, как правило, отличаются от ионогенных веществ значительным размером молекул, поскольку для придания им растворимости на каждые две метиленовые группы следует вводить не менее одной оксиэтиленовой группы в гидрофильную часть. В результате, например, уже у 6-этокси-додеканола длина молекулы почти вдвое больше, чем у додецилсульфата натрия, причем около двух третей молекулы приходится на гидрофильную оксиэтиленовую цепочку.
Таким образом, при одинаковой молярной концентрации молекулам неионогенных ПАВ потребуется значительно больший объем для размещения в структуре растворителя и, следовательно, у них концентрация насыщения раствора должна быть меньше, чем у ионогенных веществ с той же длиной углеводородного радикала.
Водные растворы дифильных веществ, содержащих гидрофобные радикалы и гидрофильные оксиэтиленовые группы, можно представить как совокупность областей, в которых молекулы растворителя - воды - могут находиться в одном из следующих состояний:
1) невозмущенные молекулы, образующие структуру, типичную для воды при данной температуре;
2) молекулы воды, связанные с эфирными атомами кислорода оксиэтиленовых групп, т.е. сольватная часть растворителя;
3) молекулы структурных образований вокруг гидрофобных углеводородных радикалов.
В соответствии с моделью водных растворов О.Я. Самойлова можно считать, что растворение неионогенных ПАВ идет по механизму внедрения-замещения, когда углеводородный радикал располагается в больших пустотах первичной структуры воды, частично занимая вакантные места, частично вытесняя «гидрофобные» полостные молекулы воды, а возникновение водородных связей между эфирными кислородными атомами оксиэтиленовых групп и молекулами воды приводит к образованию новых структурных образований, по своим свойствам лишь незначительно отличающихся от льдоподобной структуры.
Способность углеводородов стабилизировать структуру воды впервые была предположена в работе Фрэнка и Эванса и в последующем доказана различными учеными, в частности, в работах Шераги и в настоящее время является общепризнанной. По результатам спектроскопических исследований было установлено, что введение дифильных веществ, имеющих достаточно развитый углеводородный радикал, приводит к более резкому проявлению полосы поглощения, характерной для льда. По спектроскопическим данным эффект добавок таких веществ аналогичен понижению температуры и исчезает при переходе системы из молекулярного раствора в ассоциированное - мицеллярное, т.е. когда исчезает контакт между углеводородными радикалами и водой.
Расчет гидратации неионогенных ПАВ в мицеллах (при выражении в количестве связанных молекул воды одной оксиэтиленовой группой) показывает, что, независимо от строения молекул (степени оксиэтилирования и размера углеводородного радикала), эта величина примерно постоянна. При 25oС она составляет около четыре молекул воды на каждую оксиэтиленовую группу. Такие результаты позволяют сделать заключение, что в мицеллах углеводородные цепи не стабилизируют структуру воды.
Гидратация молекул в разбавленных растворах зависит от строения углеводородного радикала. При увеличении числа метиленовых групп возрастает число стабилизированных молекул воды. Молекулы с относительно коротким углеводородным радикалом и низким значением степени оксиэтилирования оказывают слабое воздействие на структуру окружающего растворителя, стабилизируя и связывая незначительное количество молекул воды. Это говорит о способности таких молекул в определенной мере приспосабливаться к окружающей структуре воды, что возможно при размещении метиленовых групп углеводородных радикалов в больших первичных пустотах квазикристаллической решетки воды. Увеличение длины углеводородного радикала и особенно переход от линейного к разветленно-циклическому приводит к резкому возрастанию числа стабилизированных молекул воды. Это свидетельствует о том, что в растворах этих веществ происходит образование новой льдоподобной структуры воды вокруг углеводородных радикалов, не способных к размещению в уже имеющихся пустотах.
Повышение температуры в большей степени сказывается на гидратации молекул растворенного вещества в разбавленных растворах, чем в мицеллах. Это связано с кооперативностью водородных связей в разбавленных молекулярных растворах, когда отсутствует контакт и взаимодействие между молекулами растворенного вещества. В мицеллах при непосредственном контакте ассоциированных молекул ПАВ кооперативность водородных связей встречает стерические препятствия.
На основании результатов исследования гидратации и строения молекулярных растворов ПАВ можно предположить следующий механизм ассоциации молекул ПАВ. Дифильные молекулы, окруженные льдоподобной структурой растворителя вокруг углеводородных радикалов и гидратной оболочкой полярных групп, будут находиться преимущественно в некотором фиксированном положении, около которого смогут совершать лишь колебательное движение. Для выхода из этого положения потребуется разрушить экранирующую углеводородный радикал льдоподобную оболочку, т.е. затратить работу на разрыв определенного числа водородных связей. В некоторые моменты экранирующая оболочка может быть ослаблена в результате процесса обмена молекулами между различными структурными образованиями воды. Тогда наиболее «активные» молекулы растворенного вещества окажутся способными преодолеть этот энергетический барьер и произойдет их переход в новое равновесное положение.
Если в момент выхода из равновесного положения встретятся две «активные» молекулы, то возможна их ассоциация за счет проявления ван-дер-ваальсова притяжения углеводородных радикалов. Однако в разбавленных растворах время жизни таких ассоциатов должно быть невелико, так как их образование энергетически невыгодно в связи с тем, что единичные молекулы способны в некоторой степени приспосабливаться к окружающей структуре воды, располагаясь углеводородными радикалами в готовых пустотах, тогда как вокруг объединенных углеводородных цепей потребуется образование новой структурной формы воды. Поэтому образование ассоциатов должно происходить при достижении определенной критической концентрации, когда вакантные места в пустотах структуры растворителя будет отсутствовать, т.е. критическая концентрация - это предельная концентрация насыщения вакантных мест в структуре растворителя, предел насыщения молекулярных растворов. Кроме того, количество растворенных молекул должно быть таким, чтобы среднее расстояние между ними соответствовало протяженности действия сил притяжения и, наконец, достаточным, чтобы при объединении в ассоциаты углеводородные цепи растворенного вещества были изолированы от контакта с водой. Естественно, что переход из молекулярного состояния в ассоциативное будет осуществляться в определенной области концентраций растворов, в которой возможно неустойчивое состояние системы с незавершенной структурой ассоциатов - мицелл.
Факторы, способствующие предразрушению структуры воды и снижающие стабилизирующее действие углеводородных радикалов и гидратацию гидрофильных групп, должны снижать энергетический барьер ассоциации и способствовать объединению молекул растворенного вещества в мицеллы.
Наибольший вклад в развитие учения о строении растворов коллоидных ПАВ внесли Мак-Бэн, Ребиндер, Хартли, Дебай и ряд других видных ученых.
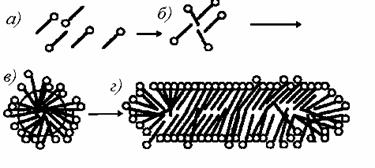
Рис. 2.57. Схема образования и трансформации мицелл в водных растворах ПАВ: a – молекулярный раствор; б – предассоциат молекул ПАВ; в – сферическая мицелла Ребиндера-Хартли; г – асимметричная мицелла Дебая-Мак-Бэна |
В соответствии с представлениями, развитыми Мак-Бэном, в растворах ионогенных ПАВ первоначально возникают небольшие сильно заряженные агрегаты молекул (предмицеллы), состоящие всего из нескольких (3-5) молекул. Такие мелкие агрегаты в настоящее время называют предассоциатами. Затем эти предассоциаты будут увеличиваться в результате включения новых молекул (ионов) ПАВ, что приводит к формированию сферических мицелл, существование которых впервые постулировал Ребиндер и почти одновременно с ним Хартли. Такие мицеллы могут содержать от нескольких десятков до сотен и даже тысяч молекул ПАВ. Мицеллы представляют собой динамические образования, непрерывно обменивающиеся молекулами (ионами) ПАВ с молекулярным раствором. Схема образования мицелл показана на рис. 2.57.
Если мицеллы образованы из ионов ПАВ, то вокруг них формируется двойной ионный слой. Кроме того, в результате взаимодействия полярных групп молекул (ионов) ПАВ и молекул воды вокруг мицелл образуется гидратная оболочка. Ядро мицелл ПАВ состоит из углеводородных цепей. Эти гидрофобные цепи вытесняются из воды в ядро мицеллы аналогично тому, как они вытесняются из объема раствора на поверхность при образовании адсорбционного слоя. При этом оказываются справедливыми те же общие закономерности, что приводит к линейной зависимости логарифма критической концентрации мицеллообразования от числа атомов углерода в гидрофобной углеводородной цепочке молекул ПАВ. Логарифм ККМ в водных растворах линейно снижается при увеличении числа метиленовых групп в углеводородных цепочках.
Эта зависимость может быть описана уравнением
скрит = А ехр{-(DW/RT)nc}, (2.6.6)
где А – некоторая постоянная для гомологического ряда ПАВ величина, характеризующая взаимодействие полярных групп с водой и между собой в мицеллах; DW – работа переноса одной метиленовой группы из водной среды в ядро мицеллы (величина, слабо зависящая от природы ионогенных групп), nc– число атомов углерода в линейных углеводородных радикалах молекул ПАВ.
При дальнейшем увеличении концентрации растворов ПАВ сферические мицеллы становятся асимметричными, по форме напоминающими сфероцилиндр, схема разреза которого показана на рис. 2.57, г. Образование таких мицелл впервые постулировал Дебай. Доказал их существование Мак-Бэн при изучении асимметрии рассеяния света в растворах ПАВ после некоторой критической концентрации, которая была названа второй критической концентрацией мицеллообразования. Вторая критическая концентрация мицеллообразования больше первой ККМ, как правило, на один - два порядка в зависимости от природы молекул ПАВ. Мак-Бэн предложил называть такие асимметричные мицеллы «сосидж»-мицеллами.
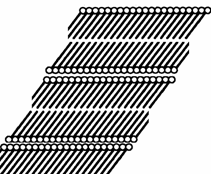
Асимметричные мицеллы могут также расти в результате поглощения новых порций ПАВ и при достаточно высоких концентрациях происходит переход к пластинчатым мицеллам. Образование таких мицелл, по своим свойствам аналогичным жидким кристаллам, при высоких концентрациях растворов ПАВ было предсказано Дебаем и доказано Штауффом при исследованиях дифракции рентгеновских лучей. Схема такой мицеллы показана на рис. 2.58.
Если в качестве растворителя взята не вода, а какой-либо углеводород, то образование мицелл ПАВ также возможно, однако они будут иметь обратную ориентацию молекул - полярная часть
Рис. 2.58. Схема пластинчатой мицеллы Штауффа (фрагмент разреза) |
ориентирована внутрь мицеллы, а углеводородные цепи - в сторону растворителя. Ядро таких мицелл должно быть гидратированным, т.е. содержать некоторое количество молекул воды, образующих как бы центр мицеллизации.
В последнее время теория мицеллообразования в водных растворах ПАВ, основанная на термодинамическом подходе к проблеме, была развита в работах А.И. Русанова. Вместе с тем следует отметить, что общей теории мицеллообразования и мицеллярных равновесий в растворах ПАВ в настоящее время не существует.
Одна из первых попыток теоретического обоснования мицеллообразования была сделана Дебаем. Основной предпосылкой теории Дебая являлось рассмотрение электростатических сил отталкивания ионизированных полярных групп в поверхностном слое мицелл. Однако это оказалось недостаточным и теория Дебая не выдержала проверки временем. С получением класса неионогенных ПАВ (в 40-50-е годы нашего столетия) оказалось, что эти вещества склонны к мицеллизации еще в большей степени, чем типичные анионактивные или катион- активные коллоидные ионогенные ПАВ (коллоидные электролиты). К растворам неионогенных ПАВ теория Дебая оказалась неприменимой. Теории мицеллообразования, которые существуют в настоящее время, позволяют объяснить причину и механизм возникновения мицелл, но не дают возможности теоретически предсказать критические концентрации мицеллообразования в растворах ПАВ различного строения. Поэтому был предложен ряд способов расчета ККМ по групповым числам, аналогично расчету гидрофильно-липофильного баланса молекул ПАВ, о чем будет рассказано ниже.