Амфотерность
Амфотерность (от греч. amphóteros — и тот и другой), способность некоторых веществ в зависимости от условий проявлять либо кислотные, либо основные свойства; амфотерные вещества иногда называют амфолитами. Примерами могут служить гидроокиси алюминия, цинка, хрома и некоторых др. элементов. Так, Al(OH)3 в водном растворе диссоциирует по двум направлениям:
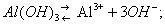
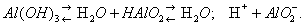
В присутствии кислот преобладает первый тип диссоциации и соединение ведёт себя как основание, в присутствии более сильных оснований — как кислота:
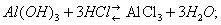
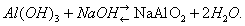
Типичное амфотерное соединение — вода:
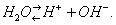
Степень амфотерности гидроокиси зависит от положения элемента в периодической системе элементов Д. И. Менделеева. В современной теории кислот и оснований понятие амфотерности сохраняет своё значение, однако трактуется несколько сложнее (см. Кислоты, Основания).
Пример органических амфолитов — аминокислоты, содержащие основную группу —NH2 и кислотную —COOH.

Дополнения к описанию амфотерности: