Кирхгофа уравнение
Кирхгофа уравнение, равенство, выражающее температурную зависимость теплового эффекта химических реакций через разность теплоемкостей конечных продуктов и исходных веществ. В частности, для реакций, происходящих при постоянном объеме, Кирхгофа уравнение связывает температурную зависимость изменения внутренней энергии DU при реакции с разностью изохорных теплоёмкостей Cv в форме
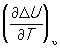 = Cv,2 — Cv,1,
= Cv,2 — Cv,1,
где Cv,1 и Cv,2 — суммы теплоёмкостей исходных веществ и продуктов реакции с учётом их стехиометрических коэффициентов в уравнении реакции. Интегрируя это уравнение, можно определить изменение внутренней энергии DUT при интересующей температуре Т, если известны DUT1 при какой-нибудь другой температуре T1 и теплоёмкости исходных веществ и продуктов реакции в рассматриваемом температурном интервале. Кирхгофа уравнение было выведено Г. Р. Кирхгофом в 1858.
В. А. Киреев.
Комментарии*
Дополнения к описанию уравнения Кирхгофа:
- Формулировка для изобарных процессов - для реакций при постоянном давлении уравнение связывает температурную зависимость изменения энтальпии ΔH с разностью изобарных теплоёмкостей: d(ΔH)/dT = ΔCp
- Практическое применение - широко используется в химической термодинамике для расчёта тепловых эффектов реакций при различных температурах, когда экспериментальные данные доступны только при одной температуре
- Математическая форма - представляет собой дифференциальное уравнение первого порядка, интегрирование которого требует знания зависимости теплоёмкостей от температуры (Cp = a + bT + cT² + ...)
- Значимость - фундаментальное уравнение химической термодинамики, позволяющее предсказывать термические характеристики химических процессов в широком температурном диапазоне
- Ограничения - предполагает, что в рассматриваемом температурном интервале не происходит фазовых переходов или других процессов, изменяющих теплоёмкость
*Подобраны с помощью LLM, верифицированы, но возможны неточности.
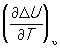 = Cv,2 — Cv,1,
= Cv,2 — Cv,1,
Дополнения к описанию уравнения Кирхгофа: