Авогадро закон
Авогадро закон, один из основных законов идеальных газов, согласно которому в равных объёмах различных газов при одинаковых температурах и давлениях содержится одинаковое число молекул. Число молекул в одном моле называют Авогадро числом. Авогадро закон открыт А. Авогадро в 1811. Однако из-за господствовавшего в науке 1-й половины 19 в. смешения понятий атома, эквивалента и молекулы Авогадро закон только с 1860 стал широко применяться в физике и химии. Из Авогадро закона следует:
1) 1 кмоль любого идеального газа при одинаковых температурах и давлениях занимает один и тот же объём, равный 22,4136 м3 при давлении 101 325 н/м2 (760 мм рт. ст.) и температуре 0°С;
2) плотности r2 и r1 двух идеальных газов при одних и тех же давлении и температуре прямо пропорциональны (и удельные объёмы n1 и n2 обратно пропорциональны) их молекулярным массам M2 и M1 :
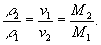

Дополнения: