Изоферменты
Изоферменты, или изоэнзимы,– это множественные формы фермента, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по физическим и химическим свойствам, в частности по сродству к субстрату, максимальной скорости катализируемой реакции (активности), электрофоретической подвижности или регуляторным свойствам.
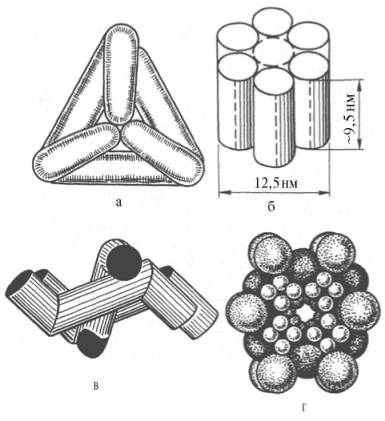
Рис. 4.5. Модели строения некоторых олигомерных ферментов.
а - молекула глутаматдегидроге-назы, состоящая из 6 протоме-ров (общая мол. м. 336000); б -молекула РНК-полимеразы; в -половина молекулы каталазы; г - молекулярный комплекс пи-руватдегидрогеназы.
В живой природе имеются ферменты, молекулы которых состоят из двух и более субъединиц, обладающих одинаковой или разной первичной, вторичной или третичной структурой. Субъединицы нередко называют протомерами, а объединенную олигомерную молекулу – мультимером (рис. 4.5; см. главу 1).
Считают, что процесс олигомеризации придает субъединицам белков повышенную стабильность и устойчивость по отношению к действию денатурирующих агентов, включая нагревание, влияние протеиназ и др. Однако на нынешнем этапе знаний нельзя ответить однозначно на вопрос о существенности четвертичной структуры для каталитической активности ферментов, поскольку пока отсутствуют методы, позволяющие в «мягких» условиях разрушить только лишь четвертичную структуру. Применяемые обычно методы жесткой обработки (экстремальные значения рН, высокие концентрации гуанидинхлорида или мочевины) приводят к разрушению не только четвертичной структуры, но и вторичной и третичной структур стабильного олигомерного фермента, протомеры которого оказываются денатурированными и, как следствие этого, лишенными биологической активности.
Следует указать на отсутствие ковалентных, главновалентных связей между субъединицами. Связи в основном являются нековалентными, поэтому такие ферменты довольно легко диссоциируют на протомеры. Удивительной особенностью таких ферментов является зависимость активности всего комплекса от способа упаковки между собой отдельных субъединиц. Если генетически различимые субъединицы могут существовать более чем в одной форме, то соответственно и фермент, образованный из двух или нескольких типов субъединиц, сочетающихся в разных количественных пропорциях, может существовать в нескольких сходных, но не одинаковых формах. Подобные разновидности фермента получили название изоферментов (изоэнзимов или, реже, изозимов). В частности, если фермент состоит из 4 субъединиц двух разных типов – Н и М (сердечный и мышечный), то активный фермент может представлять собой одну из следующих комбинаций: НННН, НННМ, ННММ, НМММ, ММММ, или Н4, Н3М, Н2М2, НМ3, М4, соответствующую изоферментам ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4 и ЛДГ5. При этом синтез Н- и М-типов осуществляется различными генами и в разных органах экспрессируется по-разному.
В одних случаях субъединицы имеют почти идентичную структуру и каждая содержит каталитически активный участок (например, β-галакто-зидаза, состоящая из 4 субъединиц). В других случаях субъединицы оказываются неидентичными. Примером последних может служить трипто-фансинтаза, состоящая из 2 субъединиц, каждая из которых наделена собственной (но не основной) энзиматической активностью, однако, только будучи объединенными в макромолекулярную структуру, обе субъединицы проявляют триптофансинтазную активность.
Термин «множественные формы фермента» применим к белкам, катализирующим одну и ту же реакцию и встречающимся в природе в организмах одного вида. Термин «изофермент» применим только к тем множественным формам ферментов, которые появляются вследствие генетически обусловленных различий в первичной структуре белка (но не к формам, образовавшимся в результате модификации одной первичной последовательности).
Одним из наиболее изученных 4 ферментов, множественность форм которого детально изучена методом гель-электрофореза, является ЛДГ, катализирующая обратимое превращение пировиноградной кислоты в молочную. Пять изоферментов ЛДГ образуются из 4 субъединиц примерно одинакового размера, но двух разных типов. Поскольку Н-протомеры несут более выраженный отрицательный заряд при рН 7,0–9,0, чем М-про-томеры, изофермент, состоящий из 4 субъединиц Н-типа (Н4), при электрофорезе будет мигрировать с наибольшей скоростью в электрическом поле к положительному электроду (аноду). С наименьшей скоростью будет продвигаться к аноду изофермент М4, в то время как остальные изо-ферменты будут занимать промежуточные позиции. Следует подчеркнуть, что изоферменты ЛДГ, обладая почти одинаковой ферментативной активностью, различаются некоторыми физико-химическими свойствами: молекулярной массой, электрофоретической подвижностью, отношением к активаторам и ингибиторам и др., однако для каждой ткани в норме характерно свое соотношение форм (изоферментный спектр) ЛДГ. Например, в сердечной мышце преобладает Н4, т.е. ЛДГ1 , а в скелетных мышцах и печени – М4 (ЛДГ5) (рис. 4.6). Эти обстоятельства широко используют в клинической практике, поскольку изучение появления изоферментов ЛДГ (и ряда других ферментов) в сыворотке крови может представлять интерес для дифференциальной диагностики органических и функциональных поражений органов и тканей. По изменению содержания изоферментов в сыворотке крови можно судить как о топографии патологического процесса, так и о степени поражения органа или ткани.
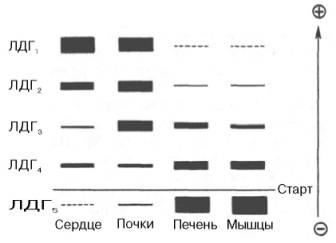
Рис. 4.6. Распределение и относительные количества изоферментов ЛДГ в различных органах. Экстракты нанесены на линию, отмеченную надписью «Старт». При заданных условиях опыта (рН) 4 изофермента ЛДГ движутся к аноду, а один (ЛДГ5) – к катоду. Красным цветом выделены основные изоформы ЛДГ для данного органа.


