АТФ
Нуклеотидный кофермент аденозинтрифосфат [АТФ (АТР)] является наиболее важной формой сохранения химической энергии в клетках. Расщепление АТФ — высоко экзоэргическая реакция. Химическая энергия гидролиза АТФ (ΔG, см. с. 22) может использоваться для сопряжения с эндоэргическими процессами, такими, как биосинтез, движение и транспорт. Другие нуклеозидтрифосфатные коферменты (ГТФ, ЦТФ и УТФ), химически похожие на АТФ, выполняют в метаболических процессах иные функции.
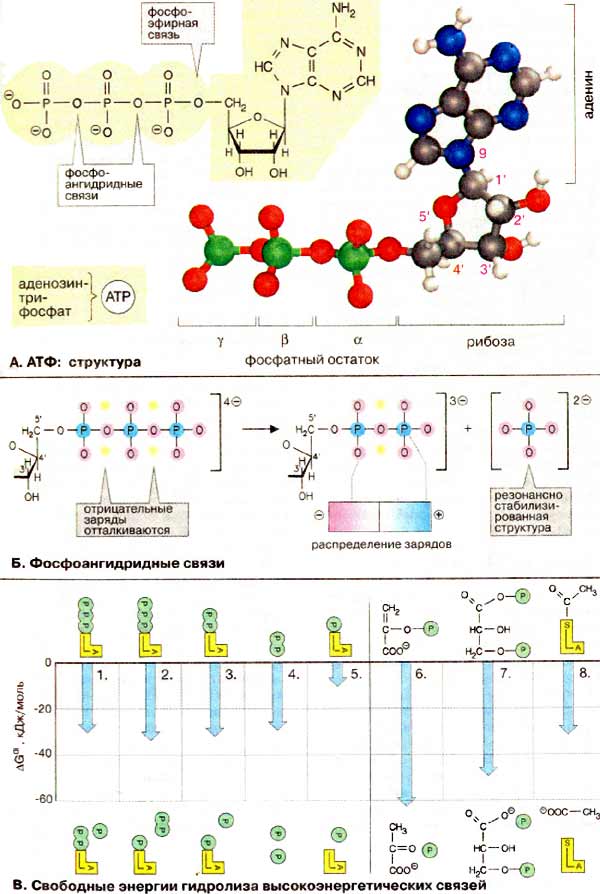
А. АТФ: структура
В АТФ цепочка из трех фосфатных остатков связана с 5'-OH-группой аденозина. Фосфатные группы обозначаются как α, β и γ. Рибоза связана с α-фосфатом фосфоэфирной связью. Три фосфатных остатка соединены между собой менее устойчивыми фосфоангидридными связями. При физиологических значениях рН АТФ несет четыре отрицательных заряда. Собственно действующим коферментом является комплекс АТФ с ионом Mg2+, координационно связанным с α- и β-фосфатом (Mg2+ ּ АТФ4-, на рисунке не показан). Для простоты чаще всего говорят только об АТФ.
Б. Фосфоангидридные связи
Показанная на схеме А формула с изображением фосфатных остатков с простыми и двойными связями не совсем точно отражает распределение зарядов: в АТФ атомы кислорода всех трех фосфатных остатков несут примерно одинаковый отрицательный заряд, в то время как атомы фосфора заряжены положительно. Одной из причин относительной нестабильности фосфоангидридных связей является сильное отталкивание отрицательно заряженных атомов кислорода, которое ослабевает при гидролитическом отщеплении концевой фосфатной группы. Поэтому такие реакции являются высоко экзоэргическими. Кроме того, при гидролизе АТФ возникает свободный фосфат-анион, который лучше гидратирован и более эффективно стабилизирован за счет сопряжения, чем соответствующий остаток в АТФ. Это также способствует высоко экзоэргическому характеру гидролиза АТФ.
В. Свободная энергия гидролиза высокоэнергетических связей
Изменение свободной энергии ΔGo' гидролиза фосфоангидридных связей в АТФ при рН 7 в стандартных условиях составляет от -30 до -35 кДж/моль. Независимо от того, какая из ангидридных связей АТФ при этом расщепляется, величина ΔGo' остается практически постоянной (1-3). Даже расщепление пирофосфата (4) дает в итоге более -30 кДж/моль, в то время как расщепление сложноэфирной связи между рибозой и фосфатом высвобождает только -9 кДж/моль (5).
В клетке действительное изменение свободной энергии при гидролизе АТФ ΔG' еще гораздо выше, так как концентрации АТФ, АДФ и неорганического фосфата (Рi) существенно более низки, чем в стандартных условиях, а АТФ присутствует в избытке по сравнению с АДФ. На величину ΔG' влияют также величина рН и концентрация ионов Mg2+. Предположительно в физиологических условиях энергия гидролиза АТФ до АДФ и неорганического фосфата равна примерно -50 кДж/моль.
Немногие соединения содержат связи с энергией гидролиза, достаточной, чтобы за счет энергетического сопряжения обеспечить синтез АТФ из АДФ и Рi (субстратное фосфорилирование, см. с. 152). К таким молекулам с высоким потенциалом переноса групп принадлежат фосфоенолпируват (6) и 1,3-дифосфоглицерат (7). Оба соединения являются промежуточными продуктами гликолиза. Также «богаты энергией» ацильные производные кофермента А (8), такие, как сукцинил-КоА, гидролиз которого до сукцината сопряжен в цитратном цикле с синтезом ГТФ. Другой богатой энергией фосфатной связью обладает креатинфосфат, с помощью которого в мышце при необходимости может регенерироваться АТФ.


