Химические связи
А. Гибридизация орбиталей и химические связи
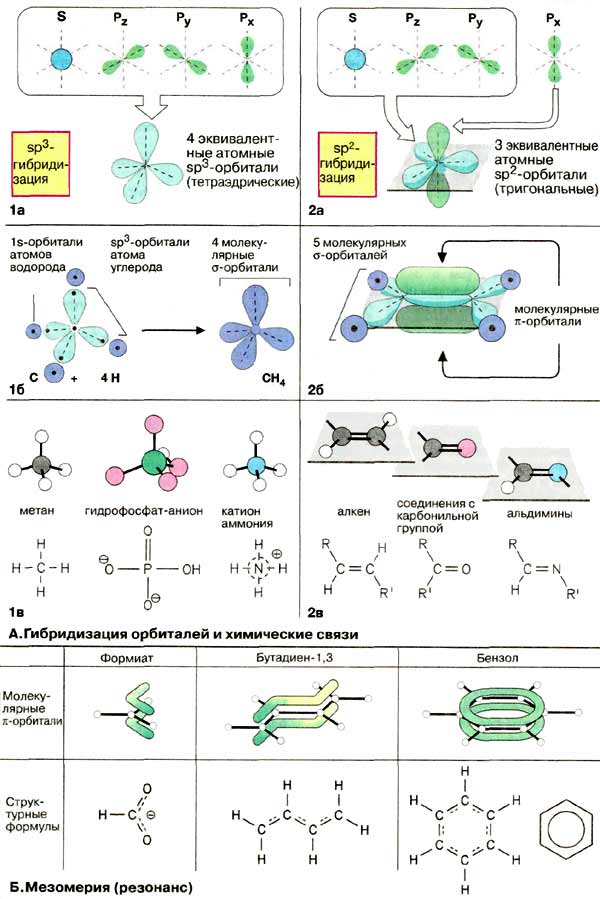
Большинство биомолекул - соединения углерода с водородом, кислородом, азотом, серой или фосфором. Устойчивые ковалентные связи между этими атомами неметаллов образуются в результате перекрывания определенных орбиталей двух атомов и формирования молекулярных орбиталей, на которых располагаются по одному электрону от каждого атома. Так, четыре валентных электрона атома углерода занимают атомные орбитали 2s и 2р (1а). 2s-Орбиталь имеет форму шара (шаровую симметрию), а три 2р-орбитали - форму гантелей, вытянутых вдоль осей х, у, z. Следовало ожидать, что атомы углерода будут образовывать по крайней мере две различные молекулярные орбитали. Однако в действительности все четыре связи эквивалентны за счет гибридизации орбиталей. Благодаря суммированию энергий одной s- и трех р-орбиталей атом углерода образует четыре равноценные sр3-атомные орбитали, направленные по осям тетраэдра (sр3-гибридизация). Перекрывание таких орбиталей с 1s-орбиталями атомов водорода приводит к образованию четырех σ-молекулярных орбиталей (1б). Это означает, что валентность атома углерода равна четырем, а в молекуле метана (СН4) имеются четыре простые (одинарные) ковалентные связи. По такому же принципу образуются простые связи между другими атомами. Так, фосфат-анион и катион аммония также имеют тетраэдрическую форму (1в).
Часто встречается тип связи, образованной за счет гибридизации 2s-орбитали только с двумя из трех 2р-орбиталей (sр2-гибридизация, 2а). В результате формируются три эквивалентные гибридные sр2-орбитали, расположенные в одной плоскости под углом 120°. Оставшаяся 2рх-орбиталь располагается перпендикулярно плоскости. При формировании молекулярных орбиталей такие атомы могут образовывать два различных типа связей (2б): три sр2-орбитали образуют σ-связи, как описано выше, а электроны двух 2рх-орбиталей от двух атомов, т.е. π-электроны, - вытянутую молекулярную π-орбиталь над и под плоскостью, занимаемой σ-связями. Этот тип связи носит название двойной связи. Двойные связи состоят из одной σ- и одной π-связей. Такой тип связи образуется лишь при наличии sр2-гибридизации у двух атомов, принимающих участие в ее образовании. В отличие от простой связи вращение вокруг двойных связей невозможно, поскольку это должно вызывать разрушение π-орбиталей. Поэтому атомы при двойной связи лежат в одной плоскости (2в), что в свою очередь делает возможным существование цис- и транс-изомеров.
Б. Мезомерия (резонанс)
Некоторые молекулы, содержащие несколько двойных связей, оказываются значительно менее реакционноспособными, чем следовало ожидать. В подобных молекулах π-орбитали не имеют четкой локализации между соседними атомами, а образуют общую молекулярную π-орбиталь. Такие соединения носят название мезомеров (резонансных гибридов), поскольку их строение невозможно представить с помощью обычных химических формул (более подробно теория мезомерии обсуждается в учебниках по химии).
На схеме и в последующих разделах книги делокализованные π-орбитали обозначаются штрихами. К мезомерным (резонансно стабилизированным) системам относятся карбоксильные группы, например формиатная, углеводороды с сопряженными двойными связями, такие, как бутадиен-1,3, и мезо-мерные циклические соединения, которые носят название ароматических. Наиболее известным представителем этого класса соединений является бензол, циклическая система которого содержит шесть π-электронов.


