1.4. ВЫЧИСЛЕНИЕ ТЕПЛОТ ОБРАЗОВАНИЯ
Теплоты образования молекул являются фундаментальными термохимическими величинами. Однако их значение для многих органических соединений неизвестны, поэтому квантовохимические расчеты этих величин представляют большой интерес с точки зрения органической химии.
Параметры полуэмпирических методов МЧПДП/3 и МПДП подобраны так, чтобы наилучшим образом воспроизвести экспериментальные теплоты образования органических соединений при нормальных условиях. Средняя ошибка при вычислении теплот образования молекул методом МЧПДП/3 составляет 38 кДж/моль, а методом МПДП — 25 кДж/моль [37].
Сложнее вычислить теплоты образования и теплоты атомизации молекул неэмпирическими методами. Даже для небольших молекул неэмпирический расчет в базисе 6-31ГФ* приводит к ошибкам в теплотах образования, превышающим 100 кДж/моль. Это связано с неполнотой использованного базиса и неучетом энергии электронной корреляции. С увеличением размера молекулы ошибки в неэмпирически вычисленных теплотах образования хотя и возрастают, но в значительной степени носят систематический характер. Поэтому их можно уменьшить с помощью коррекции конечных результатов по аддитивной схеме. Если предположить, что при образовании молекул из атомов ошибки вследствие неполноты использованного базиса и пренебрежения электронной корреляцией одинаковы для всех молекул, то при вычислении энергий атомизации ЕА можно воспользоваться следующей формулой:
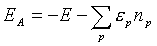
где Е — полная энергия молекулы, вычисленная неэмпирическим методом;
np — число атомов с номером р (р — номер атома в периодической системе элементов)
в молекуле; εр — эмпирический (корректирующий) параметр для атома с номером р; сумма берется по всем атомам с номерами р, из которых состоит молекула. В корректирующие инкременты можно включить также энергию нулевых колебаний.
Таблица 1.4 Экспериментальные теплоты образования и ошибки при вычислении этих величин квантовохнмнческимн методами (кДж/моль)
|
Экспериментальная величина НА |
Ошибка при вычислении методом |
|||
|
3-21ГФ |
6-31ГФ* |
МПДП |
||
|
-75 |
-4 |
2 |
25 |
|
|
-85 |
1 |
8 |
2 |
|
|
-104 |
2 |
8 |
0 |
|
|
-52 |
-7 |
-10 |
12 |
|
|
21 |
8 |
-10 |
0 |
|
|
цис-Бутен-2 |
-8 |
— |
15 |
-9 |
|
транс-Бутен-2 |
-13 |
-13 |
13 |
-9 |
|
Н2С=СМе2 |
-18 |
-16 |
12 |
9 |
|
Н2С=С=СН2 |
192 |
-11 |
-29 |
-8 |
|
Н2С=СН-СН=СН2 |
109 |
-20 |
52 |
12 |
|
С2Н2 |
228 |
-7 |
-33 |
12 |
|
CH3C≡CH |
186 |
2 |
-25 |
-15 |
|
CH3C≡CСН3 |
146 |
2 |
20 |
-44 |
|
НС≡С-С≡СН |
475 |
6 |
45 |
-46 |
|
53 |
-35 |
-10 |
-6 |
|
|
Циклопропен |
278 |
-77 |
-44 |
8 |
|
Циклобутен |
158 |
-47 |
-34 |
-26 |
|
83 |
-11 |
45 |
6 |
|
|
Н2О |
-243 |
-20 |
-11 |
-14 |
|
Н2О2 |
-136 |
77 |
13 |
-24 |
|
СО |
-111 |
39 |
56 |
85 |
|
СО2 |
-395 |
31 |
64 |
79 |
|
СН3ОН |
-202 |
22 |
-21 |
-39 |
|
С2Н5ОН |
-236 |
23 |
-20 |
-29 |
|
СН2О |
-109 |
15 |
33 |
-29 |
|
-381 |
47 |
-54 |
-8 |
|
|
CH3CHO |
-167 |
15 |
83 |
-11 |
|
CH3COCH3 |
-218 |
17 |
-32 |
10 |
|
CH3OCH3 |
-185 |
48 |
-44 |
-30 |
|
NH3 |
-46 |
-4 |
-17 |
20 |
|
N2H4 |
96 |
32 |
-8 |
-36 |
|
цис-HN=NH |
214 |
-33 |
-16 |
-72 |
|
HN3 |
295 |
-72 |
44 |
11 |
|
CH3NH2 |
-23 |
14 |
0 |
-8 |
|
CH3NНCH3 |
-18 |
22 |
8 |
-9 |
|
HCN |
136 |
37 |
5 |
11 |
|
CH3CN |
88 |
58 |
14 |
-8 |
|
СН3NС |
150 |
34 |
— |
102 |
|
N≡C—C≡N |
310 |
94 |
6 |
-33 |
|
HNO2 |
-79 |
-15 |
— |
-92 |
|
N2O |
80 |
-64 |
-16 |
47 |
|
Средняя ошибка |
|
29 |
25 |
26 |
При расчете теплот образования методами 3-21 ГФ и 6-31 ГФ* использованы корректирующие параметры из табл. 1.5.
Аналогичные корректирующие параметры могут быть
подобраны для вычисления теплот образования молекул при нормальных условиях:
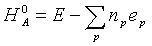
где eр - соответствующий эмпирический корректирующий параметр (поправка).
Расчеты с эмпирически подобранными значениями параметров ep показали, что с их помощью можно уменьшить ошибку в вычислении теплот образования органических молекул: при использовании базиса ОСТ-3 ГФ — до 45 кДж/моль, а при использовании базисов 3-21ГФ и 6-31ГФ* — соответственно до 29 и 25 кДж/моль (табл. 1.4). Значения поправок еp приведены в табл. 1.5.
Таблица 1.5 Корректирующие параметры ер (ат.ед1.) для расчета теплот образования молекул неэмпирическими методами [37]
|
Aтом |
Метод |
||
|
ОСТ-ЗГФ |
3-21 ГФ |
6-31ГФ* |
|
|
H С N О |
-0,57429 -37,40983 -53,74645 -73,77352 |
-0,56908 -37,67347 -54,14898 -74,36308 |
-0,56912 -37,88940 -54,46617 -74,78492 |
1 1 ат.ед,= 2626 кДж/моль.
Дальнейшего повышения точности расчета можно достигнуть при использовании корректирующих параметров еp, которые зависят не только от типа атома, но и его ближайшего окружения. Так, в работе [38] корректирующие параметры подобраны для атомов H, С, N и О, причем значение eH для атома водорода зависит от того, с каким атомом этот водород валентно связан: [еH= 0,57171 (связь с атомом С), 0,56524 (связь с атомом N) и 0,56524 (связь с атомом О), eC=37,883, eN=54,472 и eO=74,800 атомных единиц для расчетов в базисе 6-31ГФ*]. Из этих данных видно, что численные значения еН для атомов водорода, валентно-связанных с атомами углерода, азота и кислорода, различаются на 0,02 ат.ед., или 50 кДж/моль.
Такие поправки нельзя использовать при расчете поверхностей потенциальной энергии, так как в ходе реакции всегда образуются структуры, в которых одни связи частично разорваны, а другие частично образованы, и нельзя сказать, между какими атомами есть валентная связь, а между какими ее нет. Однако поправки такого типа можно использовать для расчета тепловых эффектов реакций и для решения многих других прикладных задач.