ОКСИАНТРАХИНОНЫ (гидроксиантрахиноны),
производные антрахинона, содержащие в молекуле одну или неск. гидроксильных
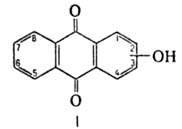
групп. Практич. значение имеют 1- и 2-
(ф-ла I), дигидроксиантрахиноны
- ализарин и хинизарин, а также мн. полигидроксиантрахиноны. Оксиантрахиноны-кристаллы
от желтого до красного и коричневого цвета (см. табл.); раств. в ледяной СН3СООН,
этаноле, диэтиловом эфире, пиридине, ароматич. углеводородах, мало или практически
не раств. в воде.
СВОЙСТВА НЕКОТОРЫХ ГИДРОКСИАНТРАХИНОНОВ
|
Положение групп
ОН в ядре антрахинона |
Тривиальное назв. |
Мол. м. |
Т.пл., °С |
Т. кип., °С |
||
|
1 |
Эритроокси-антрахинон |
224,2 |
194-195 |
Возгоняется |
||
|
2 |
- |
224,2 |
306 |
То же |
||
|
1,2 |
240,2 |
289 |
430 |
|||
|
1,4 |
240,2 |
202 |
450 (с разл.) |
|||
|
1,5 |
Антраруфин |
240,2 |
280 |
Возгоняется |
||
|
1,8 |
Хризазин |
240,2 |
193 |
Разлагается |
||
|
2,6 |
Антрафлавин |
240,2 |
>360 |
Возгоняется |
||
|
1,2,3 |
Антрагаллол |
256,2 |
313-4 |
290 (с возг.) |
||
|
1,2,4 |
Пурпурин |
256,2 |
259 |
Возгоняется |
||
|
1,2,6 |
Флавопурпурин |
256,2 |
360 |
459 |
||
|
1,2,7 |
Антрапурпурин |
256,2 |
374 |
462 |
||
|
1,2,5,8 |
Хинализарин |
272,2 |
313-16 |
Возгоняется |
||
|
1,4,5,8 |
- |
272,2 |
350 |
То же |
||
|
1,2,4,5,8 |
Ализаринцианин
R |
288,2 |
- |
-"- |
||
|
1,2,3,5,6,7 |
Руфигалловая к-та |
304,2 |
- |
- |
||
|
1,2,4,5,6,8 |
Ализаринцианин
WRR |
304,2 |
- |
- |
||
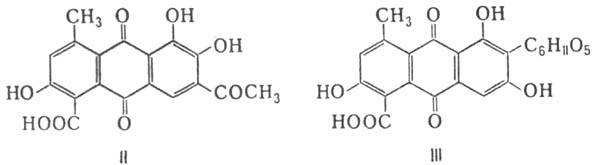
Большинство оксиантрахинонов и их производных
найдены в природе в своб. состоянии или в виде гликозидов в насекомых, грибах,
лишайниках, корнях растений; напр., пурпурин, как и ализарин, с древнейших времен
извлекают из корней краппа семейства марены красильной (Rubia tinctorum и др.
виды), кермес (кермесовая к-та; ф-ла II) и кошениль (карминовая к-та; III)-из
неск. видов насекомых (Coccus ilicis и др.) подотряда кокцидовых из группы червецов.
Для 1-оксиантрахинона характерно наличие
внутримол. водородной связи между атомом Н гидроксигруппы и атомом О карбонильной
группы, что является причиной его более низкой реакц. способности по сравнению
с др. оксиантрахинонами.
1-Оксиантрахинон при галогенировании
SOCl2 в нитробензоле превращ. в 1-гидрокси-4-хлорантрахинон, а в
присут. I2-в 2,4-ди-хлорантрахинон. При бромировании Вг2
1-оксиантрахинон образует 2,4-дибром-, а 2-оксиантрахинон -1,3-дибромпроизводное. Нитрование 1-оксиантрахинона приводит
к смеси 2- и 4-нитропроизводных. Пром. значение имеет нитрование 1,5- и 1,8-дигидроксиантрахино-нов,
приводящее к динитропроизводным - полупродуктам в произ-ве синих дисперсных
красителей. Сульфирование 1-оксиантрахинона протекает преим. в положение 2, сульфирование
2-оксиантрахинона-В положение 3; 1,5-дигидроксиантрахинон при 135°С сульфируется до 2,6-дисульфопроизводного.
Сульфогруппа в положении 2 в сильнощелочной среде легко может обмениваться на
гидроксиметильную группу; в слабощелочной среде преобладает замена группы ОН
на атом Н.
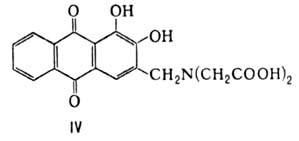
Р-ция ализарина с СН2О
и иминодиуксусной к-той протекает с образованием ализарин-комплексона ф-лы IV-реагента
для фотометрич. определения F, Сu, Са, Ва, Со, Hg, РЗЭ и др. элементов; взаимод.
хинизарина с параформом и пиперидином в ДМФА-с образованием 2-пиперидиноме-тил-1,4-дигидроксиантрахинона-промежут.
продукта в синтезе катионных красителей.
Пурпурин при нагр. с анилином
образует 2-анилино-1,4-дигидроксиантрахинон, к-рый после обработки Н3ВО3
при 160 °С с послед. сульфированием превращ. в протравной краситель
для шерсти.
При восстановлении Na2S2O4
в водно-щелочной среде многие оксиантрахиноны превращ. в гидроксиантрагидрохиноны (лейко-соединения),
обладающие высоким сродством к разл. волокнам и применяемые гл. обр. в кубовом
крашении (см. Антрахиноновые красители). Лейкосоединения легко алки-лируются
альдегидами, при взаимод. с NH3, аминами и этаноламином замещают
гидроксил на группу NH2.
В пром-сти 1-оксиантрахинон, 1,5-,
1,8- и 2,6-дигидроксиантрахиноны получают методом известкового плава, нагревая
соответствующий сульфонат в автоклаве с суспензией Са(ОН)2, MgCl2
и окислителем (NaNO3, хлорная известь) при 210-230 °С и 2 МПа
в течение 10-15 ч.
1-Оксиантрахинон -исходный продукт в
синтезе замещенных антрахино-нов, 1,8- и 1,4-дигидроксиантрахиноны-промежут.
продукты в синтезе разл. фармацевтич. препаратов-антибиотиков антрациклинов,
проявляющих противоопухолевую активность, противовоспалит. и слабит. ср-в, а
также красителей.
Пурпурин получают окислением
ализарина МnО2 или конденсацией фталевого ангидрида с гидрохиноном
с послед. окислением образующегося хинизарина МnО2; исходное сырье
для получения протравного красителя для шерсти. Флавопурпурин и антрапурпурин
синтезируют окислит. щелочным плавлением 2,6- и 2,7-антрахинондисульфокислот
соотв.; применяют в качестве красителя в ситцепечатании. Антрагаллол (с примесью
1,2,3,5,6,7-гексагидропроизводно-го) получают, нагревая смесь бензойной и 3,4,5-тригид-роксибензойной
к-ты с конц. H2SO4 или разб. олеумом; в пром-сти-краситель
антраценовый коричневый FF, или ализариновый коричневый для крашения хлопка.
Хинализарин синтезируют обработкой ализарина 70-80%-ным олеумом в присут. Н3ВО3 при 25-30 °С с послед. гидролизом (р-ция Бона-Шмидта); пром. краситель для хлопка, реагент в аналит. химии.
1,2,4,5,6,8-Гексагидроантрахинон-пром.
краситель антраценовый синий R, или ализаринцианин WRR, получают при нагр. 1,5-дигидроксиантрахинона
с дымящей H2SO4; применяют для окрашивания шерсти в синий
цвет по хромовой протраве.
Лит.: Горелик М.
В., Химия антрахинонов и их производных, М., 1983.
С. И. Диденко.