ОДНОЭЛЕКТРОННЫЙ ПЕРЕНОС,
вид донорно-акцеп-торного взаимод., завершающегося перемещением одного электрона,
к-рый покидает высшую занятую орбиталь донора и занимает низшую своб. орбиталь
акцептора. Такой процесс осуществляется легко, если указанные орбитали соответствуют
друг другу по симметрии (см. Орбиталь) и имеют подходящую разницу
в уровнях энергии.
В общем случае энергии
орбиталей, принимающих участие в одноэлектронном переносе, пропорциональны сродству акцептора к
электрону и потенциалу ионизации донора. Для одноэлектронного переноса необходимо, чтобы первая
из этих величин была бы больше второй. Чем такая разница сильнее, тем одноэлектронный перенос
идет легче. Присоединение электрона к молекуле обычно сопровождается выделением
энергии, величина к-рой соответствует электронному сродству (напр., для ароматич.
углеводородов кол-во выделяющейся энергии может составлять от 10 до 100 кДж/моль).
Отдача молекулой электрона обычно связана с поглощением энергии, необходимое
кол-во к-рой определяется потенциалом ионизации (напр., потенциалы ионизации
ароматич. углеводородов варьируют от 700 до 1000 кДж/моль).
Одноэлектронный перенос называют внешнесферным,
если окислит.-восстано-вит. взаимод. между донором и акцептором происходит непосредственно,
напр.:
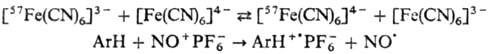
Одноэлектронный перенос называют внутрисферным, если ему предшествует образование биядерного комплекса с "мостиком" между донором и акцептором, напр.:
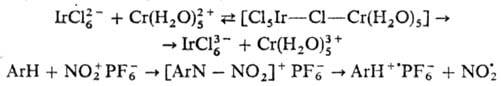
В качестве мостика в приведенных
примерах участвуют атом Сl и хим. связь.
В случае внешнесферного
механизма одноэлектронного переноса соблюдается параболич. зависимость между энергией активации
и логарифмом константы скорости р-ции (т. наз. зависимость Маркуса). Неподчинение
такой зависимости соответствует внутрисферному одноэлектронному переносу.
В р-циях с одноэлектронным переносом, к-рые
осуществляют в р-ре, важную роль играют сольватац. эффекты. Так, разница в поведении
NO+ и 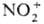 в приведенных выше р-циях обусловлена существ. различием значений энергий сольватации
(297 и 586 кДж/моль для NO+ и
в приведенных выше р-циях обусловлена существ. различием значений энергий сольватации
(297 и 586 кДж/моль для NO+ и 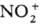 соотв.). Сольватац. эффекты компенсируют затраты энергии, к-рые расходуются
на изменение длины связей и величин валентных углов в реагирующих
частицах, на конформац. переходы и др., что необходимо для достижения переходного
состояния. Обычно снижению энергии сольватации способствуют высокая степень
сопряжения связей в молекуле, малая полярность р-рителя, отсутствие или слабое
сцепление ионных пар в молекуле, присутствие в субстрате поляризующихся фрагментов,
а также незначит. конформац. изменения в молекуле. Все это благоприятствует
одноэлектронному переносу.
соотв.). Сольватац. эффекты компенсируют затраты энергии, к-рые расходуются
на изменение длины связей и величин валентных углов в реагирующих
частицах, на конформац. переходы и др., что необходимо для достижения переходного
состояния. Обычно снижению энергии сольватации способствуют высокая степень
сопряжения связей в молекуле, малая полярность р-рителя, отсутствие или слабое
сцепление ионных пар в молекуле, присутствие в субстрате поляризующихся фрагментов,
а также незначит. конформац. изменения в молекуле. Все это благоприятствует
одноэлектронному переносу.
Одноэлектронный перенос реализуется гл. обр.
как промежут. стадия р-ций. При этом обычно образуются ион-радикалы или радикалы.
Выявление стадий одноэлектронного переноса в осуществляемой р-ции открывает нетривиальные пути управления
этими р-циями. Удалось, напр., реализовать высокую селективность при деблокировании
защищенного фенилаланина (ф-ла I) при осуществлении пептидного синтеза (обе
защитные группы омыляются в кислой среде и поэтому обычные методы их селективного
деблокирования неприемлемы):
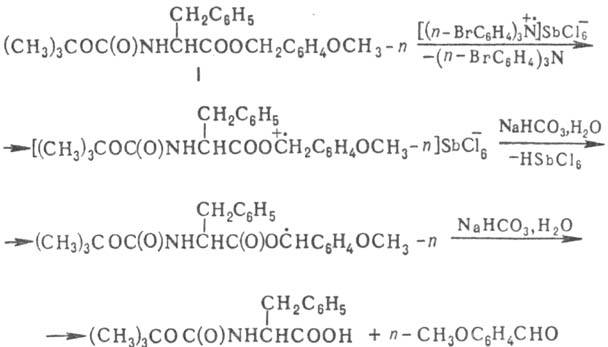
На практике склонность
разл. в-в к одноэлектронному переносу оценивают по разности их окислит.-восстановит. потенциалов,
напр. потенциалов полуволн Е1/2 обратимого одноэлектронного
восстановления. Одноэлектронный перенос осуществляется в тех случаях, когда Е1/2 акцептора
более отрицателен, чем Е1/2 донора. Одноэлектронный перенос может происходить
и при неблагоприятной разнице потенциалов в случаях реализации квантового туннелирования
(см. Туннельный эффект)или когда в качестве переносчика электрона используют
т. наз. медиатор - постороннее в-во, способное легко окислять донор и затем
восстанавливать акцептор. Так, в присут. хинонов (Q) резко облегчается одноэлектронный перенос
от n-(CH3)2NC6H4N(CH3)2
к ССl4. Добавление Zn(ClO4)2 в реакц. среду
существенно повышает скорость одноэлектронного переноса от амина (донора) к Q. В этом случае каталитич.
эффект обусловлен координацией 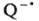 с Zn2+, что способствует сдвигу равновесия одноэлектронного переноса и накоплению катион-радикала
донора во времени. Сдвиг равновесия наблюдается и тогда, когда в результате
одноэлектронного переноса реагирующие молекулы претерпевают необратимые хим. или стереохим. изменения.
с Zn2+, что способствует сдвигу равновесия одноэлектронного переноса и накоплению катион-радикала
донора во времени. Сдвиг равновесия наблюдается и тогда, когда в результате
одноэлектронного переноса реагирующие молекулы претерпевают необратимые хим. или стереохим. изменения.
Для орг. соед. способность
вступать в р-ции одноэлектронного переноса зависит также от изотопного состава их молекул. Напр.,
дейтерир. соед. имеет более высокий потенциал ионизации и более низкое сродство
к электрону; на этом основании удается проводить изотопное разделение. Так,
используя различия в св-вах нейтральных молекул и их анион-радикалов, выделяют
C6H5NO2, обогащенный 15N. За 16
циклов одно-электронного восстановления-окисления из C6H5NO2
с естеств. содержанием 15N (0,37%) получают практически чистый C6H515NO2
(99%).
Неконтролируемый одноэлектронный перенос
считают причиной многочисл. процессов, вызывающих разл. нарушения в клетках
живых организмов. Напр., при попадании нитросоед. в организм могут образовываться
анион-радикалы в результате одноэлектронного переноса от флавопротеидов (см. Коферменты}. Эти
продукты одноэлектронного переноса далее выступают в качестве доноров по отношению к О2,
к-рый превращ. в супероксид-ион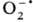 .
Последний под влиянием фермента супероксиддисмутазы в присут. солей железа
превращ. сначала в Н2О2, а затем радикалы
.
Последний под влиянием фермента супероксиддисмутазы в присут. солей железа
превращ. сначала в Н2О2, а затем радикалы  ,
к-рые взаимод. с биомолекулами,
вызывая мутации, давая начало злокачеств. перерождению клеток, нарушая ф-ции
липидов и белков. Ферменты, участвующие в переносе электронов, напр. флавопротеиды,
ферредоксин (переносит электроны от возбужденного светом хлорофилла), могут
также и напрямую осуществлять одноэлектронный перенос к акцептору. Так, необратимое повреждение
печени под действием ССl4 обусловлено распадом
,
к-рые взаимод. с биомолекулами,
вызывая мутации, давая начало злокачеств. перерождению клеток, нарушая ф-ции
липидов и белков. Ферменты, участвующие в переносе электронов, напр. флавопротеиды,
ферредоксин (переносит электроны от возбужденного светом хлорофилла), могут
также и напрямую осуществлять одноэлектронный перенос к акцептору. Так, необратимое повреждение
печени под действием ССl4 обусловлено распадом 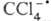 , к-рый образуется в организме, на Сl- и
, к-рый образуется в организме, на Сl- и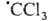 Последний захватывается печеночной тканью как сам по себе, так и в виде аддукта
с кислородом
Последний захватывается печеночной тканью как сам по себе, так и в виде аддукта
с кислородом 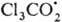 ;
оба радикала чрезвычайно токсичны.
;
оба радикала чрезвычайно токсичны.
Для обнаружения в механизме
р-ции одноэлектронного переноса используют радиоспектроскопич. методы (ЭПР, хим. поляризацию ядер),
оптич. методы с быстрой регистрацией (напр., пико-секундную лазерную спектроскопию).
Косвенным подтверждением одноэлектронного переноса служат изменение спектральных характеристик р-ра,
в частности появление полосы переноса заряда (см. Молекулярные комплексы),
и хемилюминесценция. Для идентификации р-ций, включающих одноэлектронный перенос, используют
также их ингибирование при введении посторонних радикалов, доноров или акцепторов
электрона, либо инициирование полимеризации добавленного в реакц. среду мономера
(напр., акрилонитрила). Большинство этих методов основано на фиксации ион-радикалов,
к-рые образуются при одноэлектронном переносе в клетке р-рителя (см. Клетки эффект)и
затем выходят в объем р-ра. Известны р-ции одноэлектронного переноса, идущие "неявно",
без выхода ион-радикалов из клетки р-рителя. Такие процессы распознают с помощью
косвенных методов, характерных для химии радикалов свободных.
Лит.: Тодрес 3.
В., Ион-радикалы в органическом синтезе, М., 1986; Cannon R. D., Electron transfer
reactions, L.-Boston, 1980; Eberson L., Electron transfer reactions in organic
chemistry. В., 1987; Prousek J., Reakce iniciovane pfenosem electronu, Praha,
1988; Photoinduced electron transfer, v. V. A-D, Amst., 1989. З.В. Тодрес.