НИКЕЛЯ ОКСИДЫ. Монооксид
(минерал бунзенит)-не-стехиометрич. кристаллич. соед. NiOx,
где х ~ 1; в зависимости от способа получения и состояния оксида цвет
кристаллов может меняться от светло- до темно-зеленого и далее до черного; до
252 °С устойчив a-NiO [антиферромагнетик; С0р
44,3 Дж/(моль•К); S0298 38,0 Дж/(моль•К); см.
также табл.]; выше 252°C-b-NiO; т.пл. 1682 °С, однако уже выше 1230
°С начинается диссоциация NiO на металлич. Ni и О2. Обладает
слабоосновными св-вами; в воде не раств.; восстанавливается (Н2,
С, Mg, Al и др.) до металла. С оксидами др. металлов дает двойные оксиды, напр.
типа шпинели BaNiO2.
СВОЙСТВА ОКСИДОВ И ГИДРОКСИДОВ
НИКЕЛЯ
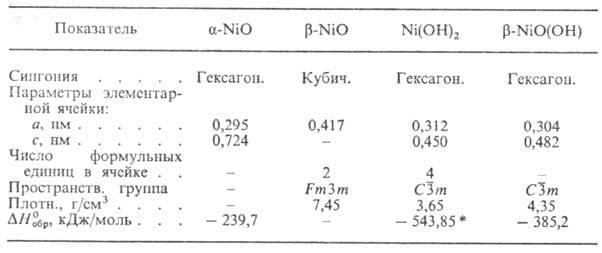
* Для свежеосажденного
DH0oбр - 531,7 кДж/моль, DG0oбр
- 477,32 кДж/моль.
Получают NiO нагреванием
соли Ni(II) при 1000-1100°С или окислением Ni при нагр. на воздухе или в
среде О2. Применяют для получения солей Ni(II) и никельсодержащих
катализаторов и ферритов, как пигмент для стекла, глазурей и керамики. ПДК в
воздухе рабочей зоны 0,005 мг/м3 (в пересчете на Ni).
Из водных р-ров солей Ni(II)
при добавлении р-римых в воде гидроксидов металлов осаждается Ni(OH)2
в виде объемного зеленого геля, кристаллизующегося при стоянии. Ni(OH)2-кристаллы;
плотн. 4,1 г/см3; S0298 80,0 Дж/(моль.К);
произведение р-римости в водном р-ре 2•10-16; легко раств. в NH3
с образованием амминокомплексов; неамфотерен; при 230-250 °С разлагается
до NiO. На электрохим. окислении Ni(OH)2 в щелочном р-ре основано
применение гидроксидов Ni в щелочных железоникелевых или кадмий-никелевых аккумуляторах.
Существование высших оксидов
Ni нельзя считать твердо установленным, хотя имеются сообщения о получении никеля оксида состава NiOl,33-2,0 окислением NiO, NiCl2, Ni(OH)2
кислородом при 200-400 °С или солей Ni(II) бромом в щелочном р-ре. Однако
индивидуальность выделенных фаз как хим. соед. определенного состава не доказана.
Предполагают, что механизм образования подобных фаз сводится к диффузии атомов
Ni из объема к пов-сти и связыванию их кислородом в неупорядоченные фазы NiOx
(x > 1,0). Имеются сообщения о выделении гидроксида Ni(OH)3
при окислении Ni(OH)2 хлором или бромом в щелочном р-ре. Однако индивидуальность
Ni(OH)3 нельзя считать доказанной, поскольку выделенное соед. Ni(III)
из щелочного р-ра идентифицировались либо как двойные оксиды MNiO2,
либо как гидроксидоксид NiO(OH).
Г и д р о к с и д о к с
и д н и к е л я(III) NiO(OH) - черные кристаллы; существует в двух модификациях
g и b- Первую получают окислением Ni смесью Na2O2 с NaOH,
вторую-обработкой бромом щелочного р-ра Ni(NO3)2 или электролизом
этого р-ра. При старении осадка NiO(OH) образуется смешанный
гидроксидоксид состава Ni3O2(OH)4. Используют
NiO(OH) для очистки никелевого электролита от Со.
П. М. Чукуров.