АЛЮМОГИДРИДЫ (тетрагидридоалюминаты, аланаты), комплексные гидриды, содержащие ион [А1Н4]-. Легко окисляются О2, энергично взаимод. с водой, р-рами к-т и щелочей, выделяя Н2. С аммиаком, галогенидами металлов и неметаллов образуют сложные комплексы. Восстанавливают орг. соед. по кратным связям углерода с др. элементами, не затрагивая связи С=С. Используют алюмогидриды как селективные восстановители и источники Н2, для получения гидридов элементов, при нанесении металлических покрытий.
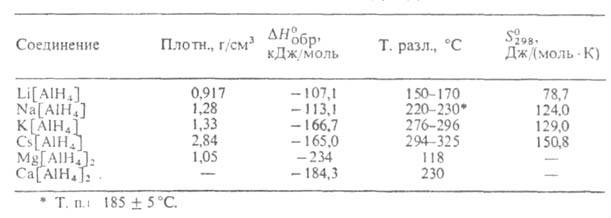
Алюмогидриды щелочных и щел.-зем. металлов (см. табл.) - бесцв. кристаллы, разлагающиеся при нагр. (алюмогидрид Be разлагается в эфире уже при - 10°С). Они раств. в ТГФ, диглиме и моноглиме, алюмогидриды Li и Mg- также в эфире. С орг. р-рителями (напр., с эфиром) образуют сольваты. Особенно прочны сольваты алюмогидридов Mg и Be, полное разложение к-рых сопровождается распадом самих алюмогидридов. Свободные алюмогидриды выделяют из р-ров в эфире и ТГФ путем отгонки р-рителя, из р-ров в ТГФ и диглиме высаливанием эфиром или толуолом. наиб. распространенные способы получения: взаимод. гидрида металла с А1На13 в полярном орг. р-рителе; прямой синтез из металла, А1 и Н2 при 100-200°С и повышенном давлении Н2 в сольватирующих р-рителях или в среде углеводородов в" присут. катализатора (алюминийорг. соед.); обменные р-ции галогенидов или борогидридов металлов с алюмогидридом Li или Na; по р-ции: Li[AlH4] + М -> М [А1Н4] + Li, где М = Na, К, Rb, Cs.
СВОЙСТВА АЛЮМОГИДРИДОВ
Алюмогидриды непереходных металлов групп III и IV и переходных металлов крайне неустойчивы. Их обычно получают взаимод. Li[AlH4] с галогенидами металлов в эфире при т-рах от —120 до — 80°С. При повышении т-ры эти алюмогидриды разлагаются с выделением Н2, (А1Н3)n и металла.
Алюмогидриды четвертичных аммониевых оснований имеют общую ф-лу R4N[A1H4]. Если R - низший алкил, то алюмогидриды - кристаллы, если высший, алюмогидриды - вязкие жидкости, более стойкие к окислению и гидролизу, чем производные низших оснований. Получают эти соединения обменной реакцией Li[AlH4] с R4NHal.
К алюмогидридам относят также гидриды, содержащие ион [А1Н6]3-(напр., Na3[AlH6] с плотн. 1,48 г/см3 и т. разл. 260°С), сложные комплексы, образуемые гидридоалюминатами щелочных и щел.-зем. металлов, напр. р-римые в эфире Li2[Mg(AlH4)4], Li[Mg(AlH4)3Cl].
Для синтеза витаминов, спиртов, оптически активных соед. используют алюмогидриды общей ф-лы М[А1НnХ4-n], где Х-алкокси и др. О три-трет-бутоксиалюмогидриде Li см. Лития алюмогидрид.
===
Исп. литература для статьи «АЛЮМОГИДРИДЫ»: Комплексы металлоорганических, гидридных и галоидных соединений
алюминия, М., 1970; Wiberg E., Amberger E., Hydrides of the elements main
groups I-IV, Amst.-L-N. Y., 1971. См. также лит. при ст. Борогидриды
металлов. А.И.Горбунов, П.А. Стороженко.
Страница «АЛЮМОГИДРИДЫ» подготовлена по материалам химической энциклопедии.