Часть 2. Дисперсные системы
Глава 1. Теория образования коллоидных систем
1.1. Общие закономерности фазового равновесия
Фазовое равновесие определяется равенством всех термодинамических параметров (температуры Т, давления Р и химического потенциала mi) в обеих фазах (обозначения которых a и b, соответственно), т.е.
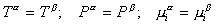 . (2.1.1)
. (2.1.1)
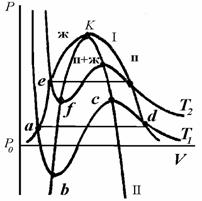
Рис. 2.1. Изотермы фазового равновесия жидкость-пар; п – пар, ж - жидкость |
На рис. 2.1 показана линия фазового равновесия I- бинодаль, геометрическое место равновесных состояний системы. Устойчивость фазы определяется условием 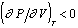 , поэтому изотермы на диаграмме «давление - объем (Р - V)» должны в области устойчивости идти сверху вниз, показывая падение давления при увеличении объема. При значениях Р и V, соответствующих равновесию фаз, изотерма T1 пересекает бинодаль I (точка а) и, если бы не существовало явлений переохлаждения, перегрева и пересыщения, дальнейший ход изотермы выражался бы прямой линией, параллельной оси ординат, отвечающей условию равновесия
, поэтому изотермы на диаграмме «давление - объем (Р - V)» должны в области устойчивости идти сверху вниз, показывая падение давления при увеличении объема. При значениях Р и V, соответствующих равновесию фаз, изотерма T1 пересекает бинодаль I (точка а) и, если бы не существовало явлений переохлаждения, перегрева и пересыщения, дальнейший ход изотермы выражался бы прямой линией, параллельной оси ординат, отвечающей условию равновесия 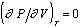 . На практике в результате явлений перегрева, переохлаждения или пересыщения изотерма, например, abcd продолжается и внутри области, ограниченной бинодалью, с отрицательным наклоном, т.е. при
. На практике в результате явлений перегрева, переохлаждения или пересыщения изотерма, например, abcd продолжается и внутри области, ограниченной бинодалью, с отрицательным наклоном, т.е. при 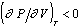 . Но в конце концов изотерма достигает минимума (точка b), после которого
. Но в конце концов изотерма достигает минимума (точка b), после которого 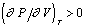 и система становится неустойчивой. Если бы этого не произошло, то термодинамическое равновесие, и сосуществование фаз, не было бы возможным.
и система становится неустойчивой. Если бы этого не произошло, то термодинамическое равновесие, и сосуществование фаз, не было бы возможным.
Область неустойчивого состояния заканчивается максимумом на изотерме I (точка с), после чего вновь 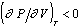 , что соответствует устойчивому состоянию, и в точке d изотерма пересекает бинодаль. Аналогичный ход будет у любой другой изотермы. Положение обоих экстремумов на изотермах определяется уравнением
, что соответствует устойчивому состоянию, и в точке d изотерма пересекает бинодаль. Аналогичный ход будет у любой другой изотермы. Положение обоих экстремумов на изотермах определяется уравнением 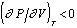 .
.
Кривую II на рис. 2.1 называют спинодалью. Она представляет собой геометрическое место максимумов (справа) и минимумов (слева) изотерм и является границей, разделяющей области устойчивых и неустойчивых состояний (внутри спинодали). Область между бинодалью и спинодалью соответствует устойчивому состоянию только в отсутствии другой фазы и называется областью метастабильных состояний. При повышении температуры область метастабильных состояний все более и более уменьшается. Оба максимума на бинодали сливаются в одну точку - точку перегиба, определяемую уравнением 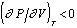 .
.
Координаты обеих фаз становятся равными, а сами фазы тождественными. Эта точка называется критической точкой K и определяется уравнениями
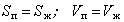 . (2.1.2)
. (2.1.2)
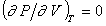 ;
; 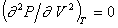 ;
;
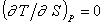 ;
; 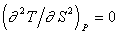 , (2.1.3)
, (2.1.3)
где V – молярный объем; S – энтропия.
Критическая точка является инвариантной и зависит только от свойств вещества.