Современные теории стерической стабилизации
Теория Мейера
В теории Мейера, описанной впервые им в 1967 г., учитывались два процесса, возможные при перекрытии адсорбционно-сольватных оболочек. Первый из них, также как и в теории Ёкеля – упругие эффекты при взаимодействии частиц, второй – эффект смешения полимерных цепей при перекрытии адсорбционно-сольватных оболочек.
Для смешения полимерных цепей молекул, закрепленных одним концом на поверхности, в ограниченном объеме между двумя непроницаемыми бесконечными пластинами был использован принцип диффузии цепей мекромолекул из адсорбционного слоя одной поверхности в элементарный объем адсорбционного слоя другой поверхности при их сближении.
В основу теории было положено уравнение Ямакавы
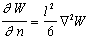 , (2.3.62)
, (2.3.62)
где W – вероятность заданного расстояния между концами цепи полимерной молекулы с n звеньями, каждое из которых имеет длину l, 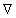 – градиент плотности сегментов.
– градиент плотности сегментов.
Расчет по этому уравнению не учитывал эффекта исключенного объема при повышении плотности упаковки цепей в зазоре между сближающимися частицами и поэтому его следует считать оценочным.
Расчет изменения свободной энергии смешения полимерных сегментов и молекул растворителя при перекрытии адсорбционно-сольватных оболочек с объемом перекрытия dV проводится с привлечением теории растворов полимеров Флори-Хаггинса, в соответствии с которой
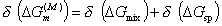 , (2.3.63)
, (2.3.63)
где DGmix – изменение энергии Гиббса при смешении молекул полимера и растворителя без учета межмолекулярных взаимодействий, определяемое из геометрического анализа возможных размещений цепей в условных ячейках раствора; DGsp– изменение свободной энергии при смешении в результате изменения межмолекулярных взаимодействий.
Из статистического рассмотрения смешения молекул растворителя и звеньев макромолекул в соответствии с теорией Флори-Хаггинса следует для комбинированного вклада
d (DGmix) = kT (dn1 lnj1 + dn2 lnj2), (2.3.64)
где dn1, dn2 – изменение числа молекул растворителя и полимерных звеньев в элементарном объеме перекрытия адсорбционно-сольватных оболочек dV;j1,j2 – объемные доли растворителя и полимерных звеньев.
Для второго члена контактного вклада в уравнении (2.3.63) теория Флори-Хаггинса дает
d (DGsp) = kT C1 (dn1)j2 , (2.3.65)
где C1– параметр межмолекулярного взаимодействия, экспериментально найденный при объемной доле полимера j2.
Учитывая, что j1 = (1-j2),dn2 = -dn1и lnj2<< ln(1-j2),получаем из уравнений (2.3.64) и (2.3.65) для изменения энергии Гиббса смешения
d (DG(M)) = kT(lnj1-lnj2 + x1j2)dn1 = kT[ln(1-j2) + xj2]dn. (2.3.66)
Разлагая в ряд ln(1-j2) = -j2 - (1/2) j22и ограничиваясь только двумя членами разложения, записываем
d(DG(M)) = kT( x1j2 - j2- 0,5 j22)dn1. (2.3.67)
Поскольку
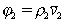 (2.3.68)
(2.3.68)
и
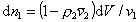 , (2.3.69)
, (2.3.69)
где r2 – плотность (число) сегментов в единице объема раствора, 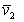 – парциальный удельный объем сегмента полимера, v1 - объем молекулы растворителя, то из уравнения (2.3.66) с учетом, что
– парциальный удельный объем сегмента полимера, v1 - объем молекулы растворителя, то из уравнения (2.3.66) с учетом, что 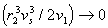 , следует
, следует
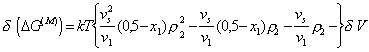 . (2.3.70)
. (2.3.70)
Уравнение (2.3.70) является фундаментальным уравнением для растворения аморфного полимера, локализованного на поверхности частиц. Первый член в правой части уравнения (2.3.70) учитывает изменение конформации макромолекул в зазоре между частицами; второй член учитывает изменение качества растворителя и изменение энергии межмолекулярного взаимодействия; третий член описывает изменение растворимости при неизменной конформации цепей макромолекул.
Изменение свободной энергии при смешении находят после интегрирования уравнения (2.3.70) в пределах от dV = 0 до V. Считается, что линейные члены при таком интегрировании остаются неизменными в связи с тем, что интеграл 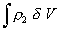 имеет смысл общего числа сегментов и не будет зависеть от расстояния между частицами. Поэтому после интегрирования все линейные члены уравнения (2.3.70) обращаются в нуль и остаются лишь квадратичные члены, поэтому
имеет смысл общего числа сегментов и не будет зависеть от расстояния между частицами. Поэтому после интегрирования все линейные члены уравнения (2.3.70) обращаются в нуль и остаются лишь квадратичные члены, поэтому
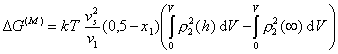 . (2.3.71)
. (2.3.71)
Второй член в уравнении (2.3.71) в квадратных скобках учитывает полную свободную энергию смешения полимерных молекул с молекулами растворителя в растворе до перекрытия адсорбционно-сольватных оболочек.
Уравнение (2.3.71) используют в качестве базового при рассмотрении различных случаев перекрытия адсорбционно-сольватных слоев, например, для двух пластин бесконечной площади, сферических частиц и т.д.
Для плоских частиц уравнение (2.3.71) записывают в виде
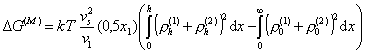 ,(2.3.72)
,(2.3.72)
где 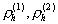 – плотность сегментов полимерных молекул, адсорбированных на поверхности частиц 1 и 2, соответственно.
– плотность сегментов полимерных молекул, адсорбированных на поверхности частиц 1 и 2, соответственно.
Предполагается, что плотность в любой плоскости, параллельной поверхности частиц, остается постоянной. Такое допущение позволяет перейти от интегрирования по объему перекрытия к интегрированию по расстоянию между частицами и отнести изменение свободной энергии при сближении частиц к единице площади их поверхности.
Принимая, что
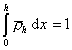 , (2.3.73)
, (2.3.73)
где 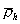 – удельная плотность сегментов, и учитывая, что
– удельная плотность сегментов, и учитывая, что
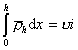 , (2.3.74)
, (2.3.74)
где u– число полимерных цепей на единице площади поверхности частиц, i-число звеньев в полимерной цепи (считается, что звено полимерной молекулы имеет размер, соизмеримый с размером молекулы растворителя), из уравнений (2.3.73) и (2.3.74) можем записать
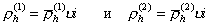 , (2.3.75)
, (2.3.75)
а для единицы поверхности частиц
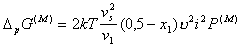 , (2.3.76)
, (2.3.76)
где P(М)- обозначает параметр распределения плотности полимерных цепей в зазоре между частицами, который определяется как
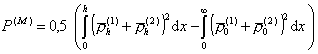 . (2.3.77)
. (2.3.77)
Обозначая термодинамический параметр в уравнении (2.3.76) как U ,
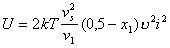 , (2.3.78)
, (2.3.78)
можем записать
DpG(M) = UP(M). (2.3.79)
Уравнение (2.3.79) представляет собой частный случай для частиц с плоской поверхностью общего уравнения
DG(M) = g U S, (2.3.80)
где g – коэффициент формы частиц; S – параметр пространственного распределения цепей в зазоре между частицами.
Уравнения (2.3.79) и (2.3.80) не учитывают вклада упругого сжатия. Уравнение для расчета этого вклада предложил Мейер. Он использовал уравнение Ямакавы для расчета вероятности распределения цепей и уравнение Больцмана для определения энтропии
DG(el) = -TDS = - 2nkT lnPn (h) , (2.3.81)
где Pn(h) – вероятность размещения элементов цепей в зазоре между частицами, множитель 2 учитывает наличие двух поверхностей.
Практический расчет функции Pn представляет значительную трудность. Дальнейшее развитие теории Мейера было проведено в работах Хесселинка, который предложил следующее уравнение для свободной энергии отталкивания плоских частиц с адсорбированными цепями полимерных молекул
D(p)G(a) = (4p/9)3/2n2kT(a2-1) <r2> M(h) + 2nkTV(h), (2.3.82)
где <r2> – среднеквадратичное расстояние между концами полимерной цепи; a - степень набухания клубков; М(h) – функция осмотического отталкивания ; V(h)- функция ограничения объема.
Для сферических частиц было получено уравнение
D(s)G(a) = [(2/27) p5/2]n2 kT a <r2> (a2 – 1) S(M), (2.3.83)
где a – радиусчастиц;
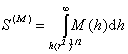 . (2.3.84)
. (2.3.84)
Эта функция для сферических частиц табулирована.
Расчет упругого вклада показал, что для сферических частиц его роль несоизмеримо мала по отношению к вкладу смешения и поэтому его не учитывают.
Последующее развитие теория отталкивания частиц дисперсной фазы, стабилизированных полимерными молекулами, была развита в работах Эдвардса и Долина. В этих работах нет того искусственного разделения энергии Гиббса при стерическом взаимодействии, как это было сделано в теориях Майера и Хеселинка, в них использовался принцип исключенного объема при взаимодействии сегментов макромолекул.
Полученные уравнения оказались бесполезными для практических расчетов и поэтому мы не будем их здесь рассматривать. Желающие углубить свои знания в этой области коллоидной науки могут ознакомиться с их изложением по монографии Наппера.