Гесса закон, основной закон термохимии, согласно которому тепловой эффект реакции зависит лишь от начального и конечного состояний системы и не зависит от промежуточных состояний и путей перехода. Гесса закон был открыт Г. И. Гессом в 1840 на основе экспериментальных исследований. Он представляет собой одну из форм позднее открытого закона сохранения энергии в применении его к химическим реакциям и относится к процессам, происходящим при постоянном объёме или при постоянном давлении. Гесса закон широко используется для определения расчётным путём теплового эффекта интересующего процесса на основе экспериментальных данных, относящихся к др. процессам (в т. ч. даже к процессам, практически недоступным в данных условиях). Так, для 298,15 К теплоту образования окиси углерода (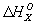 ккал/моль) из графита можно рассчитать, зная, что теплоты сгорания
ккал/моль) из графита можно рассчитать, зная, что теплоты сгорания 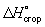 окиси углерода и графита до CO2 при этой температуре равны соответственно —282,99 и —393,32 кдж/моль (—67,635 и—94,051 ккал/моль). Рассматривая два пути образования CO2 из графита при непосредственном сжигании его до CO2 и при промежуточном образовании СО (см. рис.) и зная, что по Гесса закону общий тепловой эффект обоих путей перехода должен быть одинаковым, находим
окиси углерода и графита до CO2 при этой температуре равны соответственно —282,99 и —393,32 кдж/моль (—67,635 и—94,051 ккал/моль). Рассматривая два пути образования CO2 из графита при непосредственном сжигании его до CO2 и при промежуточном образовании СО (см. рис.) и зная, что по Гесса закону общий тепловой эффект обоих путей перехода должен быть одинаковым, находим 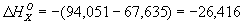 ккал/моль (теплота выделяется).
ккал/моль (теплота выделяется).
В. А. Киреев.
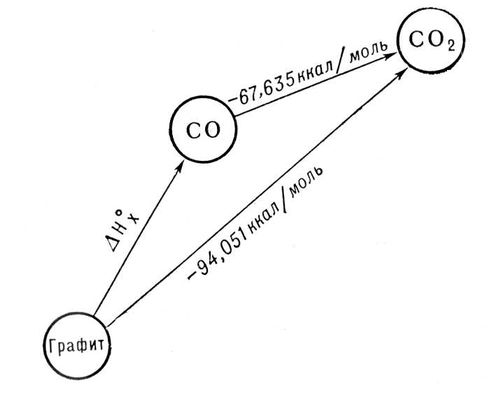
Схема, иллюстрирующая закон Гесса.