Ванадий (Vanadium), V, химический элемент V группы периодической системы Менделеева; атомный номер 23, атомная масса 50,942; металл серо-стального цвета. Природный ванадий состоит из двух изотопов: 51V (99,75%) и 50V (0,25%); последний слабо радиоактивен (период полураспада Т1/2 = 1014 лет). Ванадий был открыт в 1801 мексиканским минералогом А. М. дель Рио в мексиканской бурой свинцовой руде и назван по красивому красному цвету нагретых солей эритронием (от греч. erythrós — красный). В 1830 шведский химик Н. Г. Сефстрём обнаружил новый элемент в железной руде из Таберга (Швеция) и назвал его ванадием в честь древнескандинавской богини красоты Ванадис. Английский химик Г. Роско в 1869 получил порошкообразный металлический ванадий восстановлением VCl2 водородом. В промышленном масштабе ванадий добывается с начала 20 в.
Содержание ванадия в земной коре составляет 1,5-10-2% по массе, это довольно распространённый, но рассеянный в породах и минералах элемент. Из большого числа минералов ванадия промышленное значение имеют патронит, роскоэлит, деклуазит, карнотит, ванадинит и некоторые др. (см. Ванадиевые руды). Важным источником ванадия служат титаномагнетитовые и осадочные (фосфористые) железные руды, а также окисленные медно-свинцово-цинковые руды. Ванадий извлекают как побочный продукт при переработке уранового сырья, фосфоритов, бокситов и различных органических отложений (асфальтиты, горючие сланцы). См. также Ванадаты природные.
Физические и химические свойства. Ванадий имеет объёмноцентрированную кубическую решётку с периодом a = 3,0282 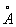 . В чистом состоянии ванадий ковок, легко поддаётся обработке давлением. Плотность 6,11 г/см3, tпл 1900 ± 25°С, tкип 3400°С; удельная теплоёмкость (при 20—100°С) 0,120 кал/гград; термический коэффициент линейного расширения (при 20—1000°С) 10,6·10-6 град-1, удельное электрическое сопротивление при 20 °С 24,8·10-8 ом·м (24,8·10-6 ом·см), ниже 4,5 К ванадий переходит в состояние сверхпроводимости. Механические свойства ванадия высокой чистоты после отжига: модуль упругости 135,25 н/м2(13520 кгс/мм2), предел прочности 120 нм/м2 (12 кгс/мм2), относительное удлинение 17%, твердость по Бринеллю 700 мн/м2 (70 кгс/мм2). Примеси газов резко снижают пластичность ванадия, повышают его твёрдость и хрупкость.
. В чистом состоянии ванадий ковок, легко поддаётся обработке давлением. Плотность 6,11 г/см3, tпл 1900 ± 25°С, tкип 3400°С; удельная теплоёмкость (при 20—100°С) 0,120 кал/гград; термический коэффициент линейного расширения (при 20—1000°С) 10,6·10-6 град-1, удельное электрическое сопротивление при 20 °С 24,8·10-8 ом·м (24,8·10-6 ом·см), ниже 4,5 К ванадий переходит в состояние сверхпроводимости. Механические свойства ванадия высокой чистоты после отжига: модуль упругости 135,25 н/м2(13520 кгс/мм2), предел прочности 120 нм/м2 (12 кгс/мм2), относительное удлинение 17%, твердость по Бринеллю 700 мн/м2 (70 кгс/мм2). Примеси газов резко снижают пластичность ванадия, повышают его твёрдость и хрупкость.
При обычной температуре ванадий не подвержен действию воздуха, морской воды и растворов щелочей; устойчив к неокисляющим кислотам, за исключением плавиковой. По коррозионной стойкости в соляной и серной кислотах ванадий значительно превосходит титан и нержавеющую сталь. При нагревании на воздухе выше 300°С ванадий поглощает кислород и становится хрупким. При 600—700°С ванадий интенсивно окисляется с образованием пятиокиси V2O5, а также и низших окислов. При нагревании ванадия выше 700°С в токе азота образуется нитрид VN (tпл 2050°С), устойчивый в воде и кислотах. С углеродом ванадий взаимодействует при высокой температуре, давая тугоплавкий карбид VC (tпл 2800°С), обладающий высокой твёрдостью.
Ванадий даёт соединения, отвечающие валентностям 2, 3, 4 и 5; соответственно этому известны окислы: VO и V2O3 (имеющие основной характер), VO2 (амфотерный) и V2O5 (кислотный). Соединения 2- и 3-валентного ванадия неустойчивы и являются сильными восстановителями. Практическое значение имеют соединения высших валентностей. Склонность ванадия к образованию соединений различной валентности используется в аналитической химии, а также обусловливает каталитические свойства V2O5. Пятиокись ванадия растворяется в щелочах с образованием ванадатов.
Получение и применение. Для извлечения ванадия применяют: непосредственное выщелачивание руды или рудного концентрата растворами кислот и щелочей; обжиг исходного сырья (часто с добавками NaCl) с последующим выщелачиванием продукта обжига водой или разбавленными кислотами. Из растворов методом гидролиза (при рН = 1—3) выделяют гидратированную пятиокись ванадия. При плавке ванадийсодержащих железных руд в домне ванадий переходит в чугун, при переработке которого в сталь получают шлаки, содержащие 10—16% V2O5. Ванадиевые шлаки подвергают обжигу с поваренной солью. Обожжённый материал выщелачивают водой, а затем разбавленной серной кислотой. Из растворов выделяют V2O5. Последняя служит для выплавки феррованадия (сплавы железа с 35—70% ванадия) и получения металлического ванадия и его соединений. Ковкий металлический ванадий получают кальциетермическим восстановлением чистой V2O5 или V2O3; восстановлением V2O5 алюминием; вакуумным углетермическим восстановлением V2O3; магниетермическим восстановлением VC13; термической диссоциацией йодида ванадия. Плавят ванадий в вакуумных дуговых печах с расходуемым электродом и в электроннолучевых печах.
Чёрная металлургия — основной потребитель ванадия (до 95% всего производимого металла). Ванадий входит в состав быстрорежущей стали, её заменителей, малолегированных инструментальных и некоторых конструкционных сталей. При введении 0,15—0,25% ванадия резко повышаются прочность, вязкость, сопротивление усталости и износоустойчивость стали. Ванадий, введённый в сталь, является одновременно раскисляющим и карбидообразующим элементом. Карбиды ванадия, распределяясь в виде дисперсных включений, препятствуют росту зерна при нагреве стали. Ванадий в сталь вводят в форме лигатурного сплава — феррованадия. Применяют ванадий и для легирования чугуна. Новым потребителем ванадия выступает быстро развивающаяся промышленность титановых сплавов; некоторые титановые сплавы содержат до 13% ванадия. В авиационной, ракетной и др. областях техники нашли применение сплавы на основе ниобия, хрома и тантала, содержащие присадки ванадия. Разрабатываются различные по составу жаропрочные и коррозионностойкие сплавы на основе ванадия с добавлением Ti, Nb, W, Zr и Al, применение которых ожидается в авиационной, ракетной и атомной технике. Интересны сверхпроводящие сплавы и соединения ванадия с Ga, Si и Ti.
Чистый металлический ванадий используют в атомной энергетике (оболочки для тепловыделяющих элементов, трубы) и в производстве электронных приборов.
Соединения ванадия применяют в химической промышленности как катализаторы, в сельском хозяйстве и медицине, в текстильной, лакокрасочной, резиновой, керамической, стекольной, фото и кинопромышленности.
Соединения ванадия ядовиты. Отравление возможно при вдыхании пыли, содержащей соединения ванадия. Они вызывают раздражение дыхательных путей, лёгочные кровотечения, головокружения, нарушения деятельности сердца, почек и т.п.
Ванадий в организме. Ванадий — постоянная составная часть растительных и животных организмов. Источником ванадия служат изверженные породы и сланцы (содержат около 0,013% ванадия), а также песчаники и известняки (около 0,002% ванадия). В почвах ванадия около 0,01% (в основном в гумусе); в пресных и морских водах 1·107—2·107%. В наземных и водных растениях содержание ванадия значительно выше (0,16—0,2%), чем в наземных и морских животных (1,5·10-5—2·10-4%). Концентраторами ванадия являются: мшанка Plumatella, моллюск Pleurobranchus plumula, голотурия Stichopus mobii, некоторые асцидии, из плесеней — чёрный аспергилл, из грибов — поганка (Amanita muscaria). Биологическая роль ванадия изучена на асцидиях, в кровяных клетках которых ванадий находится в 3- и 4-валентном состоянии, то есть существует динамическое равновесие
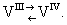
Физиологическая роль ванадия у асцидии связана не с дыхательным переносом кислорода и углекислого газа, а с окислительно-восстановительными процессами — переносом электронов при помощи так называемой ванадиевой системы, вероятно имеющей физиологическое значение и у др. организмов.
Лит.: Меерсон Г. А., Зеликман А. Н., Металлургия редких металлов, М., 1955; Поляков А. Ю., Основы металлургии ванадия, М., 1959; Ростокер У., Металлургия ванадия, пер. с англ., М., 1959; Киффер P., Браун Х., Ванадий, ниобий, тантал, пер. с нем., М., 1968; Справочник по редким металлам, [пер. с англ.], М., 1965, с. 98—121; Тугоплавкие материалы в машиностроении. Справочник, М., 1967, с. 47—55, 130—32; Ковальский В. В., Резаева Л. Т., Биологическая роль ванадия у асцидии, «Успехи современной биологии», 1965, т. 60, в. 1(4); Воwen Н. J. М., Trace elements in biochemistry, L. — N. Y., 1966.
И. Романьков. В. В. Ковальский.