Бороводороды, гидриды бора, бораны, соединения бора с водородом. Известны бороводороды, содержащие от 2 до 20 атомов бора в молекуле. Простейший бороводород, BH3, в свободном состоянии не существует, он известен лишь в виде комплексов с аминами, эфирами и т.п. Характер связей в бороводородах очень своеобразен, они являются электрондефицитными соединениями, т. е. не имеют достаточного числа электронов для связывания всех атомов обычными двухэлектронными валентными связями. В диборане B2H6 (рис.) каждый атом бора связан с двумя атомами водорода обычными связями; между собой атомы бора связаны трёхцентровыми «мостиковыми» связями, возникающими в результате обобществления пары электронов тремя атомами — двумя В и одним H (показаны пунктиром). Структура других бороводородов ещё сложнее. Бороводороды, в отличие от углеводородов, образуют не цепочки атомов, а сложные пространственные структуры. Низшие бороводороды — газы (B2H6 и B4H10 — тетраборан) и жидкости (B5H9 — пентаборан), высшие (B10H14 — декаборан и др.) — твёрдые вещества. Бороводороды бесцветны, имеют неприятный запах и очень ядовиты. Низшие бороводороды легко окисляются, самовоспламеняясь на воздухе при невысоких температурах (ниже 100°С), и легко разлагаются водой с выделением водорода и образованием борной кислоты. Высшие бороводороды более устойчивы и менее реакционноспособны. Все бороводороды при температуре выше 700 °С разлагаются на бор и водород.
Диборан получают взаимодействием хлористого или фтористого бора с гидридами металлов (LiH, NaH, NaBH4, LiAlH4), гидрированием хлористого бора водородом и другими способами. Высшие бороводороды получают термическим разложением диборана.
Теплоты сгорания бороводородов значительно превышают теплоты сгорания других соединений, поэтому бороводороды представляют большой интерес как перспективное ракетное топливо. B2H6 применяют для получения элементарного бора и для нанесения боридных покрытий на металлы. Некоторые производные бороводородов могут служить исходными продуктами для получения термостойких полимеров. Металлические производные бороводородов называются борогидридами. B2F6 и др. Бороводороды и некоторые их производные весьма токсичны.
Лит.: Некрасов Б. В., Основы общей химии, т. 2, М., 1967; Михайлов Б. М., Химия бороводородов, М., 1967; Жигач А. Ф., Стасиневич Д. С., Химия гидридов, Л., 1969; Паушкин Я. М., Химия реактивных топлив, М., 1962.
В. Л. Василевский.
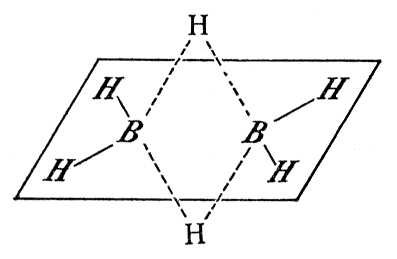
Рисунок к ст. Бороводороды.