Электропроводность электролитов обусловлена наличием в них положительных и отрицательных ионов (катионов и анионов). Доли общего количества электричества, переносимого катионами и анионами, называются переноса числами. Электропроводность электролитов количественно характеризуют эквивалентной электропроводностью L:
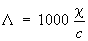 ,
,
где c — удельная электропроводность раствора (в ом-1·см-1), с —- его концентрация (в г·экв/л). Предельно разбавленному раствору, в котором молекулы электролита полностью диссоциированы на ионы, соответствует наибольшее значение L, равное сумме эквивалентных электропроводностей катионов и анионов (см. также Кольрауша закон).
Эквивалентная электропроводность электролитов уменьшается с ростом концентрации раствора. В растворах слабых электролитов L быстро падает с ростом с, в основном из-за уменьшения подвижности ионов и степени диссоциации. В растворах сильных электролитов уменьшение L определяется главным образом торможением ионов из-за взаимодействия их зарядов, интенсивность которого растет с концентрацией вследствие уменьшения среднего расстояния между ионами, а также из-за уменьшения подвижности ионов при увеличении вязкости раствора (см. Подвижность ионов и электронов). В электрических полях большой протяжённости подвижность ионов настолько велика, что ионная атмосфера, тормозящая движение ионов, не успевает образовываться, и L резко возрастает (эффект Вина). Подобное явление наблюдается н при приложении к раствору электролита электрического поля высокой частоты (эффект Дебая — Фалькенхагена).
Электропроводность сильных электролитов удовлетворительно описывается теоретическими уравнениями лишь в области небольших концентраций, например Онсагера уравнением электропроводности.
А. И. Мишустин.