Спирты, производные углеводородов, содержащие в молекуле одну или несколько гидроксильных групп (—ОН) у насыщенных атомов углерода. Соединения с ОН-группами в ароматическом кольце называются фенолами, с ОН-группами при углерод-углеродной двойной связи — енолами.
Классификация и номенклатура. В зависимости от характера углеводородного радикала спирты могут быть ациклическими, или алифатическими (например, метиловый спирт, этиловый спирт, аллиловый спирт), алициклическими (циклогексанол), жирноароматическими (бензиловый спирт) и гетероциклическими. По числу ОН-групп в молекуле различают спирты одноатомные (алкоголи), двухатомные (гликоли),трёхатомные (см. Глицерин), четырёхатомные (см. Пентаэритрит) и др. многоатомные спирты (см. также Гекситы, Ксилит). ОН-группы в спиртах могут быть связаны с первичным (—СН2ОН), вторичным (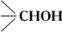 ) и третичным (
) и третичным (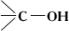 ) атомом углерода. По этому признаку одноатомные спирты делят на первичные, вторичные и третичные.
) атомом углерода. По этому признаку одноатомные спирты делят на первичные, вторичные и третичные.
Названия спиртов обычно производят от названий соответствующих углеводородных радикалов: CH3—OH (метиловый спирт), C2H5—OH (этиловый спирт), C3H7—OH (пропиловый спирт) и т.д. По Женевской номенклатуре к название соответствующего углеводорода прибавляют окончание «ол» (или диол, триол) и цифрой указывают номер атома углерода, с которым связана ОН-группа, например CH3—CH(OH)—CH3 (пропанол-2), HOCH2-CH2—CH2OH (пропандиол-1, 3). Иногда для построения название вторичных и третичных спиртов употребляют т. н. рациональную номенклатуру (см. Номенклатура химическая). Некоторые спирты имеют тривиальные название, например этиловый спирт называется винным, метиловый спирт — древесным. Спиртами называются некоторые лекарственные средства, не имеющие отношения к этому классу соединений. Например, борный, камфорный и салициловый спирт представляют собой соответственно растворы борной кислоты, камфоры и салициловой кислоты в этиловом спирте, нашатырный спирт — водный раствор аммиака.
Свойства. Низшие одноатомные алифатические спирты — бесцветные жидкости, высшие (начиная с С12) — твёрдые вещества. Спирты C1—C3 обладают характерным алкогольным запахом и жгучим вкусом, C4—C5 — сладковатым удушливым запахом (они придают неприятный запах сивушному маслу); высшие спирты без запаха. Простейшие гликоли и глицерины — вязкие жидкости. В жидком и твёрдом состоянии молекулы спиртов связаны водородными связями. Этим обусловлены их аномально высокие температуры кипения (например, CH3OH кипит при 64,7 °С, тогда как CH3SH — при 6 °С). Спирты хорошо растворяются во многих органических растворителях и сами обладают хорошей растворяющей способностью. Неограниченно смешиваются с водой одноатомные спирты (C1—C3), гликоли (до C7), глицерин; растворимость в воде спиртов (C4—C5) ограничена, высшие спирты нерастворимы. Спирты образуют азеотропные смеси с водой и рядом органических соединений, что используется, например, при абсолютировании спиртов.
Химические свойства спиртов определяются наличием ОН-группы. При взаимодействии с щелочными и некоторыми др. металлами образуются солеобразные продукты — алкоголяты, например C2H5ONa (см. Алкоголяты и феноляты), с кислотами — эфиры сложные RCOOR' (см. также Этерификация); первичные спирты в мягких условиях окисляются в альдегиды RCHO и далее в карбоновые кислоты RCOOH, вторичные — в кетоны R—CO—R. Спирты сравнительно легко дегидратируются; при этом в зависимости от природы спирта и условий реакции образуются эфиры простые ROR или олефины. Взаимодействие с PCl5 и SOCl2 приводит к алкилхлоридам RCl, RCl2 и т. д.
Получение и применение. В промышленности гидролизом алкилгалогенидов получают, например, амиловые спирты, бензиловый спирт; гидролиз сложных эфиров спиртов и серной кислоты (алкилсульфатов) — важная стадия промышленного способа получения изопропилового спирта, этилового, трет-бутилового спиртов (см. Бутиловые спирты) из олефипов. Многие спирты синтезируют прямой гидратацией олефинов в присутствии катализаторов, восстановлением карбонильных соединений — альдегидов (получаемых, например, оксосинтезом, т. е. присоединением СО и H2 к олефинам) и кетонов, карбоновых кислот и их эфиров. Гидрогенизацией окиси углерода получают, например, метиловый, н-пропиловый и изобутиловый спирты; этиловый и некоторые др. спирты — ферментативным брожением сахаров (см. Углеводы, Брожение, Гидролизная промышленность), некоторые высшие спирты — с помощью алюминийорганических соединений (т. н. альфол-процесс).
Спирты широко распространены в природе в свободном состоянии и в виде сложных эфиров. Например, жиры — эфиры глицерина (см. также Глицериды); воски — эфиры высших алифатических спиртов; фенилэтиловый спирт и ментол — составные части соответственно розового и мятногоэфирных масел; цетиловый спирт найден в пчелином воске, эфир бензилового спирта и уксусной кислоты (бензилацетат) — в эфирном масле цветов жасмина.
Спирты — важный в практическом отношении класс органических соединений; они служат полупродуктами в производстве красителей, синтетических волокон, пластических масс, лакокрасочных материалов, моющих средств, пластификаторов, эмульгаторов, лекарственных препаратов и т.д. Спирты применяют как растворители, для приготовления алкилирующих агентов и др. Низшие алифатические спирты обладают слабым наркотическим действием, некоторые спирты ядовиты (например, метиловый спирт, этиленгликоль).
Лит.: Несмеянов А. Н., Несмеянов Н. А., Начала органической химии, т. 1—2, М., 1969—70.
В. Н. Фросин.