Сероводородный метод анализа, метод химического качественного анализа смеси ионов металлов (главным образом катионов) в водных растворах. Метод основан на неодинаковой растворимости хлоридов, гидроокисей, карбонатов и сульфидов металлов.
Сероводородный метод анализа предполагает классификацию ионов металлов, представленную в таблице. Существуют и другие классификации ионов металлов. Применяя т. н. групповые реагенты — осадители (HCl, H2S, (NH4)2S, (NH4)2CO3), последовательно разделяют сложную по составу смесь ионов металлов на пять аналитических групп.
Ход систематического анализа следующий: добавлением HCl выделяют ионы V группы. Из фильтрата (pH около 3) осаждают катионы IV группы пропусканием H2S. Затем действием избытка (NH4)2S переводят в осадок катионы III группы. Оставшуюся в растворе смесь катионов II и I групп разделяют прибавлением раствора (NH4)2CO3. После этого каждую группу катионов разделяют на подгруппы и обнаруживают ионы химическими реакциями.
Сероводородный метод анализа применяется для предварительной идентификации неизвестного по составу вещества с целью выбора наиболее рационального пути его количественного анализа. Количественный сероводородный метод анализа иногда используется при анализе сложных по составу материалов.
| Аналитичес- | Состав группы | Групповой реагент | |
| I | К+, Na+, | Нет | Растворимы |
| II | Ва2+, Sr2+, Ca2+ и др. | (NH4)2 СО3 | Сульфиды растворимы, карбонаты практически нерастворимы в воде |
| III | AI3+, Cr3+, Fe2+, Fe3+, Zn2+, Co2+ и др. | (NH4)2 S | Сульфиды (или гидроокиси) растворимы в разбавленных кислотах |
| IV | 1-я подгруппа: Cu2+, Cd2+, Bi3+, Pb2+ и др. | Н2S (в присутствии HCl) | |
|
| 2-я подгруппа: As (III), As (V), Sb (III), Sn (II) и др. | то же | Сульфиды нерастворимы в разбавленных кислотах, растворимы в (NH4)2Sn |
| V | Ag+, [Hg2]2+, Cu (ll) и др. | HCl |
Лит.: Алексеев В. Н., Курс качественного химического полумикроанализа, 5 изд., М., 1973.
А. И. Бусев.
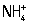 и др.
и др.