Порядок реакции, понятие кинетики химической. Порядок реакции определяется как сумма показателей степеней n1 и n2 в уравнении
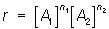 , (1)
, (1)
выражающем зависимость скорости реакции r от концентраций [A1] и [А2] исходных веществ (k — константа скорости). Реакции с n1 + n2 = 1, 2 и т.д. называются реакциями 1-го, 2-го и т.д. порядков. Отдельный показатель степени в уравнении (1) называется порядком реакции по соответствующему веществу.
У простых реакций скорость в одном направлении, согласно действующих масс закону, подчиняется уравнению (1), а n1 и n2 совпадают с числом молекул веществ A1 и А2, участвующих в элементарном акте реакции. Скорости сложных реакций иногда также выражаются уравнениями вида (1), но при этом порядок реакции может не совпадать со стехиометрическим коэффициентом вещества в уравнении реакции (записанном с наименьшими целочисленными стехиометрическими коэффициентами), может быть дробным числом. В гетерогенно-каталитических реакциях обычны наряду с целыми дробные и нулевые порядки; встречаются также отрицательные порядки.
М. И. Тёмкин.