Олефины, алкены, гомологический ряд ненасыщенных углеводородов общей формулы CnH2n с открытой цепью и одной двойной углерод-углеродной связью; относятся к ациклическим соединениям. Родоначальник ряда этилен CH2 = CH2, поэтому олефины называют также этиленовыми углеводородами. Этилен и его ближайшие гомологи (пропилен CH2 = CH – CH3, бутены C4H8, амилены C5H10 и др.) часто называют алкиленами. По Женевской номенклатуре название олефинов производят от соответствующих названию насыщенных углеводородов, заменяя окончание «ан» на «ен» и цифрой указывая положение двойной связи, например: этан ® этен (этилен), пропан ® пропен (пропилен), бутан ® бутен-1 (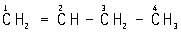 ) и бутен-2 (
) и бутен-2 (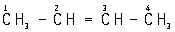 ). Начиная с бутена, в ряду олефинов появляются структурные изомеры; кроме того, вследствие наличия в молекуле двойной связи олефины могут существовать в виде геометрических изомеров (см. Изомерия).
). Начиная с бутена, в ряду олефинов появляются структурные изомеры; кроме того, вследствие наличия в молекуле двойной связи олефины могут существовать в виде геометрических изомеров (см. Изомерия).
По физическим свойствам от насыщенных углеводородов олефины отличаются мало. температуры кипения у них несколько ниже, а плотность несколько выше, чем у алканов с тем же числом атомов углерода в молекуле. Низшие олефины (от C2H4 до C4H8) — газы, до C18H36 — жидкости, далее — твёрдые вещества. Все олефины бесцветны, практически не растворимы в воде, ограниченно растворяются в спиртах, хорошо — в углеводородах и эфирах.
По двойной связи к олефинам легко присоединяются галогены (при этом образуются маслянистые жидкости; отсюда и назв.: франц. olefiant — маслородный), водород, галогеноводороды, вода; при взаимодействии с водными растворами хлора или брома образуются галогенгидрины (см., например, Этиленхлоргидрин), при окислении — гликоли, например этиленгликоль, пропиленгликоль, и окиси, например этилена окись, пропилена окись. Олефины легко изомеризуются, а также полимеризуются и сополимеризуются с образованием ценных продуктов (см. Полиолефины, Полиэтилен, Полипропилен, Полиизобутилены). Важное свойство олефинов — высокая алкилирующая способность (см., например, Изооктан).
Основной источник получения олефинов в промышленности — продукты переработки нефти и природных газов. В лабораторных условиях олефины получают дегидратацией спиртов:
CH3 – CH2OH ® CH2 = CH2 + H2O;
пиролизом сложных эфиров карбоновых кислот, Виттига реакцией и др.
Благодаря высокой реакционной способности, доступности и дешевизне олефины широко используют в нефтехимическом синтезе, для получения пластических масс, некоторых каучуков синтетических, волокон химических и др. промышленно важных продуктов.
В. Н. Фросин.