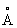Инертные газы, благородные газы, редкие газы, химические элементы, образующие главную подгруппу 8-й группы периодической системы Менделеева: гелий Не (атомный номер 2), неон Ne (10), аргон Ar (18), криптон Kr (36), ксенон Xe (54) и радон Rn (86). Из всех инертных газов только Rn не имеет стабильных изотопов и представляет собой радиоактивный химический элемент.
Название "инертные газы" отражает химическую инертность элементов этой подгруппы, что объясняется наличием у атомов инертных газов устойчивой внешней электронной оболочки, на которой у Не находится 2 электрона, а у остальных инертных газов по 8 электронов. Удаление электронов с такой оболочки требует больших затрат энергии в соответствии с высокими потенциалами ионизации атомов инертных газов (см. таблицу).
Из-за химической инертности инертные газы долгое время не удавалось обнаружить, и они были открыты только во 2-й половине 19 в. К открытию первого инертного газа — гелия — привело проведённое в 1868 французом Ж. Жансеном и англичанином Н. Локьером спектроскопическое исследование солнечных протуберанцев. Остальные инертные газы были открыты в 1892—1908.
Инертные газы постоянно присутствуют в свободном виде в воздухе. 1 м3 воздуха при нормальных условиях содержит около 9,4 л инертных газов, главным образом аргона (см. таблицу). Кроме воздуха, инертные газы присутствуют в растворённом виде в воде, содержатся в некоторых минералах и горных породах. Гелий входит в состав подземных газов и газов минеральных источников. Остальные стабильные инертные газы получают из воздуха в процессе его разделения. Источником радона служат радиоактивные препараты урана, радия и др. После использования стабильные инертные газы вновь возвращаются в атмосферу и поэтому их запасы (кроме лёгкого Не, который постепенно рассеивается из атмосферы в космическом пространстве) не уменьшаются.
Молекулы инертных газов одноатомны. Все инертные газы не имеют цвета, запаха и вкуса; бесцветны они в твёрдом и жидком состоянии. Наличие заполненной внешней электронной оболочки обусловливает не только высокую химическую инертность инертных газов, но и трудности получения их в жидком и твёрдом состояниях (см. таблицу). Другие физические свойства инертных газов см. в статьях об отдельных элементах.
| Элемент | Содержание в воздухе, об. % |
| Первые потенциалы ионизации, в | При 1 атм. (~100 кн/м2) | |||
| по А. Бонди | по В. И. Лебедеву | tпл, °С | tкип, °С | ||||
| Не | 4,0026 | 4,6·10-4 | 1,40 | 0,291 | 24,58 | —272,6* | —268,93 |
| Ne | 20,179 | 1,61·10-3 | 1,54 | 0,350 | 21,56 | —248,6 | —245,9 |
| Ar | 39,948 | 0,9325 | 1,88 | 0,690 | 15,76 | —189,3 | —185,9 |
| Kr | 83,80 | 1,08·10-4 | 2,02 | 0,795 | 14,00 | —157,1 | —153,2 |
| Xe | 131,30 | 8·10-6 | 2,16 | 0,986 | 12,13 | —111,8 | —108,1 |
| Rn | 222** | 6·10-18 | — | 1,096 | 10,75 | около —71 | около —63 |
*При 26 атм. (~2,6 Мн/м2). **Массовое число наиболее долгоживущего изотопа.
Долгое время попытки получить химические соединения инертных газов оканчивались неудачей. Положить конец представлениям об абсолютной химической недеятельности инертных газов удалось канадскому учёному Н. Бартлетту, который в 1962 сообщил о синтезе соединения Xe с PtF6. В последующие годы было получено большое число соединений Kr, Xe и Rn, в которых инертные газы имеют степени окисления +1, +2, +4, +6 и +8. При этом существенно, что для объяснения строения этих соединений не потребовалось принципиально новых представлений о природе химической связи, и связь в соединениях инертных газов хорошо описывается, например, методом молекулярных орбиталей (см. Валентность, Молекулярных орбиталей метод). Из-за быстрого радиоактивного распада Rn его соединения получены в ничтожно малых количествах и состав их установлен ориентировочно. Соединения Xe значительно стабильнее соединений Kr, а получить устойчивые соединения Ar и более лёгких инертных газов пока не удалось. В большинстве реакций инертных газов участвует фтор: одни вещества получают, действуя на инертные газы фтором или фторсодержащими агентами (SbF5, PtF6 и т. д.), другие образуются при разложении фторидов инертных газов. Имеются указания на возможность протекания реакций Xe и Кr с хлором. Получены также окислы (XeO3, XeO4) и оксигалогениды инертных газов.
Кроме указанных выше соединений, инертные газы образуют при низких температурах соединения включения. Так, все инертные газы, кроме Не, дают с водой кристаллогидраты типа Хе×6Н2О, с фенолом тяжёлые инертные газы дают соединения типа Хе×3С6Н5ОН и т. д.
Промышленное использование инертных газов основано на их низкой химической активности или специфических физических свойствах. Примеры применения инертных газов см. в статьях об отдельных элементах.
Лит.: Финкельштейн Д. Н., Инертные газы, М., 1961; Фастовский В. Г., Ровинский А. Е., Петровский Ю. В., Инертные газы, М., 1964; Крамер Ф., Соединения включения, пер. с нем., М., 1958; Бердоносов С. С., Инертные газы вчера и сегодня, М., 1966; Соединения благородных газов, пер. с англ., М., 1965; Коттон Ф., Уилкинсон Дж., Современная неорганическая химия, пер. с англ., ч. 2, М., 1969; Дяткина М. Е., Электронное строение соединений инертных газов, «Журнал структурной химии», 1969, т. 10, № 1, с. 164.
С. С. Бердоносов.